Biomimetik: Die chemischen Tricks des Blutes
Biologische Moleküle wie Hämoglobin oder Chlorophyll sind schwer zu untersuchen. Ein Team von der TU Wien und aus Triest zeigte nun, wie man von ähnlichen, künstlichen Stoffen viel lernen kann.
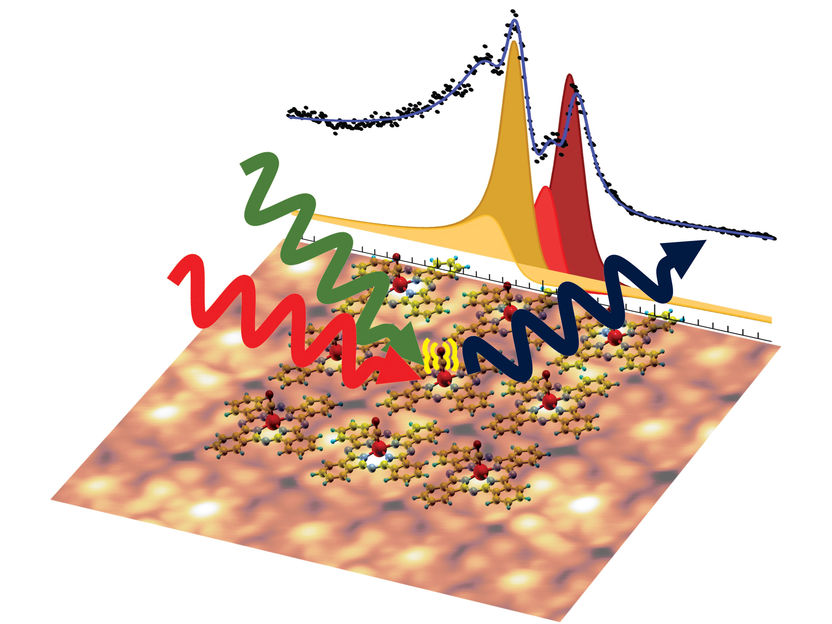
Rastertunnelmikroskopie und Laserspektroskopie an zweidimensionalen Eisen- Phthalocyanin Kristallen.
Copyright: Università degli Studi di Trieste
Hämoglobin hat eigentlich eine ganz einfache Aufgabe: Es ist dazu da, Sauerstoffmoleküle durch unsere Blutbahn zu transportieren. Das gelingt ihm aber nur deshalb so gut, weil es extrem komplex gebaut ist. Ähnliches gilt für Chlorophyll, das Sonnenlicht in Energie für Pflanzen umwandelt.
Wenn man die subtilen Tricks solcher komplexer Moleküle verstehen will, lohnt es sich, im Labor ähnliche aber einfachere Strukturen zu untersuchen. In einer Kooperation zwischen der TU Wien und Forschungsgruppen aus Triest wurden nun Phthalocyanine untersucht, deren molekulare Ringstruktur den entscheidenden Abschnitten von Hämoglobin oder Chlorophyll stark ähnelt. Dabei stellte sich heraus, dass das Zentrum dieser Ringstrukturen mit Hilfe von grünem Licht in verschiedene Zustände geschaltet werden kann, wodurch sich ihr chemisches Verhalten ändert.
Das hilft nicht nur, biologische Vorgänge besser zu verstehen, es öffnet auch neue Möglichkeiten, die Tricks der Natur im Labor für andere Zwecke zu nutzen – eine Strategie, die heute unter dem Begriff „Biomimetik“ weltweit an Bedeutung gewinnt.
Ringe mit Metallatomen in der Mitte
„Die Phthalocyanine, die wir untersuchen, sind Farbstoffe mit charakteristischer Ringstruktur“, sagt Prof. Günther Rupprechter vom Institut für Materialchemie der TU Wien. „Entscheidend an dieser Ringstruktur ist, dass sie in ihrer Mitte ein Eisenatom aufnehmen kann – genau wie die Häme, die ringförmig strukturierten roten Farbstoffe im Hämoglobin. Chlorophyll wiederum hat einen ähnlichen Ring, der Magnesium festhält.“
Im Gegensatz zu den komplizierteren natürlichen Vorbildern kann man die Phthalocyanin-Farbstoffe regelmäßig nebeneinander auf einer Oberfläche anordnen, wie Fliesen auf der Badezimmerwand. „Die Ringe wurden regelmäßig auf eine Graphen-Schicht aufgebracht, so entstand ein zweidimensionaler Kristall aus lauter gleichen Farbstoff-Ringen“, sagt Matteo Roiaz, der gemeinsam mit Christoph Rameshan die Experimente durchführte. „Das hat den Vorteil, dass wir viele Moleküle gleichzeitig untersuchen können und damit viel deutlichere Messsignale bekommen“, erklärt Christoph Rameshan.
Als Sonden zur Untersuchung der Ringe dienten Kohlenmonoxid-Moleküle: Sie können sich an dem Eisenatom anlagern, das in der Mitte des Ringes festgehalten wird. Aus der Schwingung des Kohlenmonoxid-Moleküls kann man Informationen über den Zustand des Eisenatoms gewinnen.
Um die Schwingung zu untersuchen, wurde das Molekül mit Laserlicht bestrahlt – und zwar mit einer Kombination aus grünem und infrarotem Licht. Dabei erhielt man ein Ergebnis, das auf den ersten Blick widersinnig wirkte: „Es wurde nicht einfach eine Schwingungsfrequenz des Kohlenmonoxids gemessen, sondern gleich vier verschiedene – damit hatte niemand gerechnet“, sagt Günther Rupprechter. „Die Eisenatome sind ja alle identisch, daher sollten die CO-Moleküle, die an ihnen hängen, auch alle dasselbe Verhalten zeigen.“
Wie sich herausstellte, war der grüne Lichtanteil des Lasers für einen bemerkenswerten Effekt verantwortlich: Ursprünglich sind tatsächlich alle Eisenatome völlig identisch, doch die Wechselwirkung mit grünem Licht kann sie in unterschiedliche andere Zustände umschalten. „Dass sich dadurch auch die Schwingungsfrequenz des CO-Moleküls auf dem Eisenatom ändert, zeigt uns, wie sensibel solche Strukturen auf winzige Änderungen reagieren“, sagt Günther Rupprechter. „Das ist letztlich auch der Grund, warum die Biomoleküle in unserem Körper eine so komplexe Struktur haben: Die weitverzweigten Protein-Äste haben einen minimalen Einfluss auf die Zustände des Metallatoms – doch dieser minimale Einfluss hat sehr wichtige Auswirkungen.“
Messen bei Raumtemperatur und Atmosphärendruck
Bisher konnte man ähnliche Effekte praktisch nur bei extrem tiefen Temperaturen und im Ultrahochvakuum untersuchen. „Wir haben nun aber im Labor sogar zwei Messmethoden, bei denen man solche biologisch relevanten Phänomene bei Raumtemperatur und Atmosphärendruck messen kann, mit und ohne grünem Licht“, betont Rupprechter. Das eröffnet neue Möglichkeiten, das chemische Verhalten biologischer Stoffe besser zu verstehen, es könnte auch die Chance bieten, neuartige Moleküle maßzuschneidern, um sie nach Vorbild der Natur auf ganz bestimmte chemische Einsatzzwecke hin zu optimieren.