Der Antrieb von Bakterien ist entschlüsselt
Forscher haben herausgefunden, wie Bakterien ihren Fortbewegungsapparat aufbauen
Viele Bakterien bewegen sich mithilfe langer, dünner Filamente fort. Diese sogenannten Flagellen sind bis zu zehnmal länger als die Bakterien selbst und dienen als Antrieb, indem sie in Rotation versetzt werden. So können Bakterien zum Beispiel einer Nahrungsquelle entgegenschwimmen oder zu Zellen menschlicher Schleimhäute gelangen, um sie zu infizieren. Somit dienen Flagellen auch als Werkzeuge in Infektionsprozessen und eignen sich als mögliche Angriffspunkte für neue Wirkstoffe gegen krankheitserregende Bakterien. Wie Flagellen genau aufgebaut werden und an welchen Stellen sich dieser Vorgang stören ließe, war bislang nicht bekannt. Wissenschaftler vom Helmholtz-Zentrum für Infektionsforschung (HZI) in Braunschweig haben den Mechanismus nun in Echtzeit-Beobachtungen aufgeklärt.
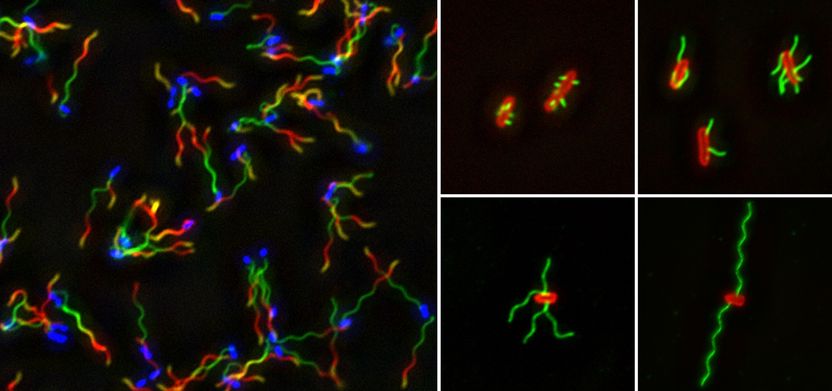
Salmonellen mit angefärbten Flagellen. Links: Jede Farbe markiert Abschnitt der Flagellen, der in definiertem Zeitintervall gewachsen ist (blau: Salmonellen). Rechts: Salmonellen (rot) mit Flagellen nach 15, 30, 90 und 240 Minuten.
© HZI/Renault et al.
Auch einem Bakterium reicht es nicht, sich immer nur treiben zu lassen: Das alltägliche Leben bringt es häufig in Situationen, in denen es sich aktiv in seiner Umgebung bewegen muss – etwa bei der Suche nach Nahrung oder einem passenden Wirt. Dann bildet es Flagellen aus – das sind lange Filamente, die es wie einen Propeller einsetzt und sich von ihnen antreiben lässt. Bakterien messen mit bestimmten Sensoren chemische Signale in ihrer Umwelt und steuern darüber die Rotationsrichtung der Flagellen. Salmonellen zum Beispiel bilden Flagellen, wenn ihre Sensoren viele Nährstoffe wahrnehmen: Das ist ein Hinweis darauf, dass sie sich in einem Darm befinden. Sie schwimmen dann mit ihrem Flagellenantrieb durch die Schleimschicht der Darmschleimhaut bis zu den Zellen der Darmwand, in die sie schließlich eindringen und eine Infektion auslösen. Bakterien der Art Escherichia coli reagieren genau entgegengesetzt: Sie bilden Flagellen nur aus, wenn ihre Sensoren zu wenig Nährstoffe messen, um dann wieder zu einer Nahrungsquelle schwimmen zu können.
Flagellen werden bis zu 20 µm lang, das entspricht dem Fünfzigstel eines Millimeters. Die nur rund 2 µm kleinen Bakterien bilden zunächst eine Art Pumpe in ihrer Membran, die gleichzeitig als Anker für das Flagellum dient. Von der Pumpe wird dann eine Vielzahl einzelner Bausteine – als Flagellin bezeichnete Einheiten – ausgeschleust, die sich außerhalb der Zelle von selbst zu einem langen Schlauch anordnen und das Flagellum bilden. In die Schlauchstruktur pumpt die Bakterienzelle fortlaufend Flagellin-Einheiten, die das Flagellum verlängern. „Für das Ausschleusen des Flagellins nutzt die Pumpe Energie, die sie aus einem Ladungsunterschied an der Membran zieht“, sagt Dr. Marc Erhardt, Leiter der Nachwuchsgruppe „Infektionsbiologie von Salmonellen“ am Helmholtz-Zentrum für Infektionsforschung (HZI). „Wie es aber gelingt, außerhalb der Zelle aus vielen Tausend einfachen Bausteinen eine hochkomplexe Struktur aufzubauen, und welche Energiequelle dort genutzt wird, war bislang unklar.“
Um dem Rätsel auf die Spur zu kommen, beobachtete das Team von Marc Erhardt das Wachstum einzelner Flagellen. Unter anderem markierten die Forscher dazu Flagellin-Bausteine von Salmonellen mit Fluoreszenz-Farbstoffen. Unter dem Mikroskop brachten sie die Bakterien dazu, Flagellen zu bilden, regten die Farbstoffe zum Leuchten an und zeichneten das Wachstum der Flagellen auf. So konnten sie erfassen, dass die Flagellen immer langsamer wuchsen, je länger sie wurden. „Ein bislang akzeptiertes Modell beschrieb einen Mechanismus, bei dem Flagellen immer mit gleicher Geschwindigkeit wachsen würden, egal wie lang sie sind“, sagt Erhardt. „Unsere Beobachtungen in Echtzeit zeigen aber, dass die Wachstumsrate mit der Länge abnimmt und dass dementsprechend ein anderer Mechanismus zugrunde liegen muss.“
Ein weiteres Experiment bestätigte das Ergebnis: Die Wissenschaftler regten wieder Salmonellen zur Flagellenbildung an und färbten die Flagellin-Bausteine während des Wachstums mit verschiedenen Fluoreszenz-Farbstoffen. Dabei wechselten sie immer nach einer festgelegten Zeit – zum Beispiel alle 30 Minuten – den Farbstoff. Am Ende konnten sie feststellen, dass die Flagellenabschnitte, die im ersten Zeitintervall gebildet wurden, am längsten waren, und dass die in den folgenden Intervallen gebildeten Abschnitte immer kürzer wurden. „Wir erklären uns die Ergebnisse so, dass die Pumpe – also das Exportsystem – permanent Flagellin aus der Bakterienzelle ins Flagellum pumpt und es dadurch anfangs schnell wachsen kann“, sagt Marc Erhardt. „Je länger das Flagellum wird, desto länger brauchen die Flagellin-Einheiten, um von der Pumpe ans Ende zu gelangen – das Wachstum wird langsamer.“ Da es kein Transportsystem für die Bausteine gibt, diffundieren sie durch das Flagellum – sie lassen sich gewissermaßen treiben. Das dauert mit zunehmender Entfernung immer länger und erklärt auf einfache Weise, warum Flagellen nicht unendlich wachsen.
Diesen Mechanismus unterstützen auch mathematische Modellrechnungen, in die die Forscher ihre Messwerte aus der Echtzeit-Mikroskopie eingespeist haben. „Die Pumpe der Flagellen ist verwandt mit anderen Sekretionssystemen von Bakterien, mit denen sie im Zuge einer Infektion zum Beispiel schädigende Substanzen in Wirtszellen transportieren“, sagt Erhardt. „Unsere Ergebnisse bieten also auch Erklärungen für den Substanzexport durch diese molekularen Spritzen.“ Solche Werkzeuge, die es Bakterien ermöglichen, Wirtszellen zu infizieren, wollen die Wissenschaftler des HZI gezielt ausschalten. Dazu suchen sie passende Wirkstoffe, die die Ausbildung oder Funktion der Werkzeuge stören und die krankmachenden Bakterien so entwaffnen.






















































