Ein Licht im dunklen Gewebe
Schaltbare Proteine für die biomedizinische Bildgebung
Biomedizinische Bildgebung hat das Ziel, das Verborgene sichtbar zu machen. Mithilfe bildgebender Verfahren können wir in das Innere von Organismen sehen, sogar einzelne Zellen können sichtbar werden. Eine der größten Herausforderungen ist es, wenige Zellen im lebenden Organismus über eine längere Zeit hinweg zu beobachten, ohne sie zu schädigen. Bei Helmholtz Munich entwickeln Forschende Werkzeuge, die dabei helfen sollen: schaltbare Proteine. Der Wissenschaftler Andre C. Stiel spricht über deren Potenzial, seine jüngste Studie und künftige Forschungsziele.
Modell schaltbarer Sensoren
Helmholtz Munich / Andre C. Stiel
Proteine für die biomedizinische Bildgebung – wie passt das zusammen?
Andre: Proteine sind Moleküle, die aus Aminosäuren bestehen. In unserem Körper und in allen Lebensformen haben Proteine viele Funktionen. Sie ermöglichen es den Zellen, Energie zu erzeugen oder Informationen zu empfangen. In der bildgebenden Forschung nutzen wir spezielle Proteine die ein Signal generieren können, um besser zu verstehen, was in unserem Körper vor sich geht. Proteine haben den Vorteil, dass sie genetisch kodiert sind. Das heißt, sie können Bestandteil einer Zelle oder eines Organismus werden. In der Bildgebung können wir diesen Effekt daher als Marker nutzen. So eröffnen sie uns spannende Möglichkeiten, um Zellen über einen langen Zeitraum in verschiedenen Zuständen zu verfolgen, ohne in das lebende Gewebe einzugreifen oder es beschädigen zu müssen – wie beispielsweise bei Markierungsfarbstoffen, die von außen zugeführt werden. So können wir unter anderem Krankheiten besser verstehen und die Wirksamkeit von Therapien auf relativ natürliche Weise untersuchen.
Was ist das Besondere an den schaltbaren Proteinen?
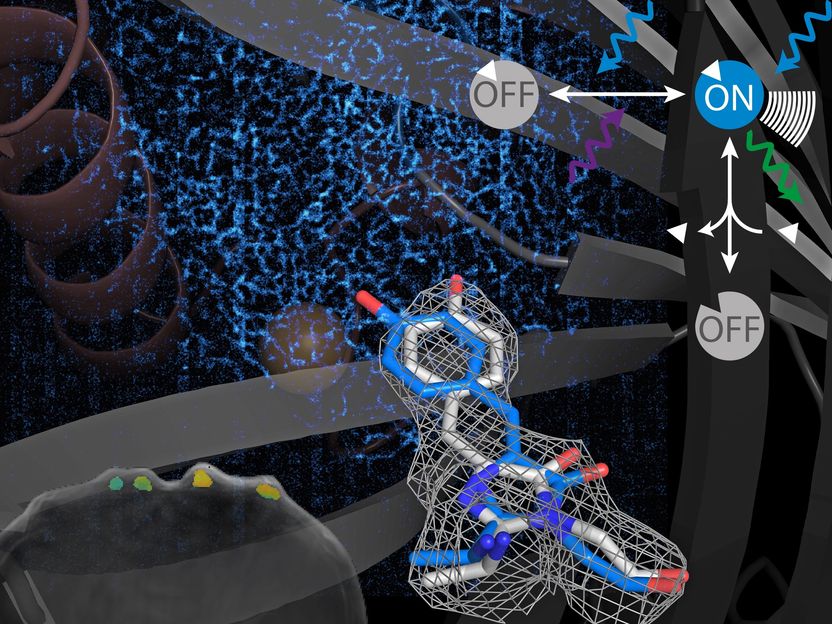
Andre: Schaltbare Proteine können ihren Zustand ändern, wenn man sie mit verschiedenen Lichtfarben beleuchtet. Dahinter liegt ein molekularer Mechanismus, der wie ein winziger Schalter wirkt. Er schaltet den Zustand des Proteins und damit das Signal, das es erzeugt, an und aus. In der Natur finden wir solche Proteine zum Beispiel bei Pflanzen, die sich nach dem Licht ausrichten.
Deine Forschungsgruppe setzt schaltbare Proteine unter anderem in der Optoakustik ein. Was bedeutet das?
Andre: Die Optoakustik ist ein Bildgebungsverfahren, das bei Helmholtz Munich international beachtet von Vasilis Ntziachristos vorangetrieben wird. Es beruht auf dem Prinzip, durch Licht erzeugte Ultraschallsignale auszulesen. Die Optoakustik liefert bereits Bilder, die eine Kombination von höherer Eindringtiefe, einer höheren Auflösung und größeren Sichtfeldern als herkömmliche Verfahren bieten. Durch die Nutzung genetisch kodierter Reporter und Sensoren könnte uns die Optoakustik noch weitere Einblicke in eine Vielzahl von Forschungsfragen liefern. Schaltbare Proteine können hier helfen. In meiner Forschungsgruppe können wir mithilfe des durch Licht schaltbaren Signals bereits eine kleine Anzahl von Zellen vor einem Hintergrund vieler anderer Signale sichtbar machen. Dafür lassen wir unsere Marker blinken. Man kann sich das wie einen Leuchtturm in einer stürmischen, dunklen Nacht auf See vorstellen. Die Fähigkeit, wenige Zellen in einem lebenden Organismus sichtbar zu machen, ist enorm wichtig. Denn viele biologische Phänomene, insbesondere in unserem Immunsystem, basieren auf einer kleinen Anzahl von Zellen. Unser Ziel ist, dass wir eines Tages einzelne markierte Zellen in einem lebenden Organismus verfolgen und ihre Funktion sichtbar machen können. Damit könnten wir viel über unser Immunsystem oder beispielsweise die Entstehung von Tumoren lernen.
Was sind die nächsten Schritte in eurer Forschung?
Andre: Bisher ging es um die Visualisierung von Zellen. Zellen selbst beinhalten jedoch auch noch kleinere Komponenten unseres Lebens: kleine Moleküle und Ionen. Oft erfüllen diese kleinen Moleküle ganz bestimmte Aufgaben. Sie dienen beispielsweise als Nährstoffquelle oder Bausteine für andere Zellbestandteile oder sind für die Kommunikation verantwortlich. Damit eine Zelle ordnungsgemäß funktionieren kann, müssen die kleinen Moleküle streng reguliert werden. Wenn wir diese Regulierung besser verstehen, können wir auch unser Wissen über gesunde und kranke Systeme verbessern. Um kleine Moleküle oder Ionen sichtbar zu machen, verwenden wir keine Marker, sondern Sensoren. Sensoren kann man sich wie Marker vorstellen, die nur dann sichtbar sind, wenn das Molekül von Interesse vorhanden ist. So können wir die Moleküle in einer Zelle sichtbar machen. In unserer jüngsten Studie haben wir unser Konzept von den schaltbaren Proteinen auf Sensoren angewandt. Wir haben gezeigt, dass schaltbare Sensoren sowohl für optoakustische als auch für hochauflösende (super resolution) Bildgebung geeignet sind, denn die Anwendung von schaltbaren Proteinen beschränkt sich nicht nur auf die Optoakustik sondern sie sind auch wichtige Hilfsmittel in der hochauflösenden Fluoreszenz-Mikroskopie. Wir haben bereits einen ersten Prototyp entwickelt, der noch Raum für Verbesserungen bietet. Aber gemeinsam mit Dierk Niessing von Helmholtz Munich haben wir die Details der molekularen Mechanismen der schaltbaren Sensoren erforscht und zusammen mit einer Gruppe des KTH in Schweden (Ilaria Testa) die ersten hochauflösenden Bilder damit erzeugt. Mithilfe solcher Sensoren werden wir in Zukunft auch die Verteilung kleiner Moleküle oder Ionen im Nanometerbereich sichtbar machen können. Und für die Optoakustik ist das Ziel letztendlich kleine Moleküle in einem lebenden Tier verfolgen zu können – das ist unsere Herausforderung für die nächsten fünf Jahre.