Forscher sehen Biomolekülen bei der Arbeit zu
Weiter entwickelte Methode erlaubt tieferen Einblick in Abläufe der Zelle
Wissenschaftlern der Universität Bonn ist es gelungen, einem wichtigen Zellprotein bei der Arbeit zuzusehen. Sie nutzten dazu eine Methode, mit der man Strukturänderungen komplexer Moleküle messen kann. Das weiter entwickelte Verfahren erlaubt es, derartige Prozesse in der Zelle zu beobachten, also der natürlichen Umgebung. Die Forscher stellen zudem eine Art Werkzeugkasten zur Verfügung, der die Vermessung unterschiedlichster Moleküle erlaubt.
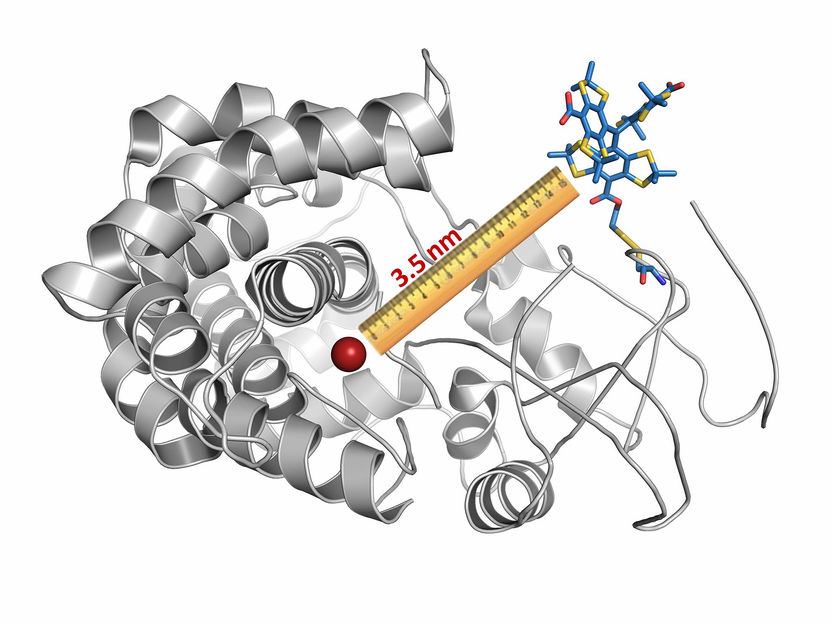
Ein Cytochrom-Molekül wurde mit einem magnetischen Etikett versehen (farbige Struktur rechts oben). Zusammen mit einem Bestandteil des Cytochroms (rot) konnte dann der Abstand bestimmt werden.
© AG Schiemann/Uni Bonn
Wenn wir eine vorweihnachtliche Walnuss öffnen wollen, benutzen wir dazu in der Regel einen Nussknacker. Der besteht im einfachsten Fall aus zwei Schenkeln, die sich um ein Gelenk gegeneinander bewegen und so Druck auf die Schale ausüben können. Ganz simpel, eigentlich – um zu begreifen, wie so ein Nussknacker funktioniert, genügt es uns, ihn ein einziges Mal in Aktion zu sehen.
Die Funktionsweise von Zellmolekülen zu verstehen, ist dagegen deutlich schwieriger. Dabei ändern auch diese bei ihrer Arbeit oft ihre räumliche Struktur – ähnlich wie der Nussknacker, bei dem die Schenkel auf- oder zuklappen. Diese Konformationsänderungen verraten Eingeweihten sehr viel über die Art und Weise, wie das Molekül seine Aufgabe erfüllt. Leider ist es jedoch sehr schwierig, derartige Bewegungen zu messen, weil sie auf einer sehr kleinen Längenskala erfolgen. Dies gilt umso mehr, wenn man die Strukturänderungen in der natürlichen Zellumgebung untersuchen will.
Der Arbeitsgruppe vom Institut für Physikalische und Theoretische Chemie der Universität Bonn ist dies nun gelungen. Die Wissenschaftler entwickelten dazu eine Methode weiter, die schon seit vielen Jahren zur Vermessung großer Moleküle eingesetzt wird. „Diese funktioniert normalerweise aber nur im Reagenzglas“, erklärt der Leiter der Studie Prof. Dr. Olav Schiemann. „Unser Verfahren lässt sich dagegen auch in Zellen einsetzen.“
Die Forscher nutzten für ihre Messungen die so genannte Elektronen Paramagnetische Resonanz-Spektroskopie. Dabei wird üblicherweise das zu vermessende Molekül an zwei verschiedenen Stellen mit einer magnetischen Markierung versehen. Durch Bestrahlung mit Mikrowellen wird dann einer dieser Minimagnete umgepolt. Dadurch ändert sich das Magnetfeld, das von ihm ausgeht, was wiederum den zweiten Magneten beeinflusst. Diese Beeinflussung ist umso größer, je näher beide Markierungen einander sind.
„Wir messen nun, wie stark der zweite Magnet auf die Umpolung des ersten reagiert“, erläutert Schiemann. „Daraus können wir auf die Entfernung der beiden Markierungen schließen.“ Wenn man nun – bildlich gesprochen – die beiden Schenkel des Nussknackers auf diese Weise markiert, lässt sich ihre Bewegung gegeneinander nachvollziehen.
Magnetische Maßbänder
Das Verfahren ist im Prinzip nicht neu. „Uns ist es jedoch gelungen, eine neue Art von Labeln herzustellen, mit der wir verschiedenste Biomoleküle ortsspezifisch markieren können", erklärt Schiemanns Mitarbeiter Jean Jacques Jassoy. Üblicherweise bestehen diese Label aus Radikalen – das sind chemische Verbindungen, die ein einzelnes freies Elektron tragen. Dieses fungiert bei der Messung als Magnet. Das Problem dabei: Einzelne Elektronen sind sehr reaktiv – sie versuchen, sich schnellstmöglich zu Elektronenpaaren zusammenzuschließen. Die Chemiker der Universität Bonn haben in ihrer Arbeit daher ein sehr stabiles Radikal verwandt – eine so genannte Tritylgruppe. Von diesem Trityl-Radikal stellten sie verschiedene Varianten her. Jedes dieser magnetischen Maßbänder eignet sich jeweils für eine bestimmte Molekülgruppe besonders gut.
In ihrer Studie untersuchten die Forscher damit ein Protein aus der Gruppe der P450-Cytochrome. Diese kommen in nahezu allen Lebewesen vor und erfüllen beispielsweise bei Oxidationsvorgängen in der Zelle wichtige Aufgaben. „Wir konnten mit unserer Methode den Abstand zwischen zwei Bereichen des Cytochroms auf Bruchteile eines Millionstel Millimeters genau vermessen“, betont Andreas Berndhäuser vom Institut für Physikalische und Theoretische Chemie.
Das Verfahren eignet sich einerseits dazu, um Konformationsänderungen von Biomolekülen in der Zelle sichtbar zu machen. Gleichzeitig erleichtert es auch generell die Aufklärung von Molekül-Strukturen. Schiemann: „Wir stellen Forschern damit einen neuen Werkzeugkasten zur Verfügung, der zur Beantwortung vieler biochemischer Fragen beitragen könnte.“
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!