Das Enzym mit dem eisernen Herzen
Ergebnisse könnten zu neuen Biokatalysatoren für eine nachhaltige Biotechnologie führen
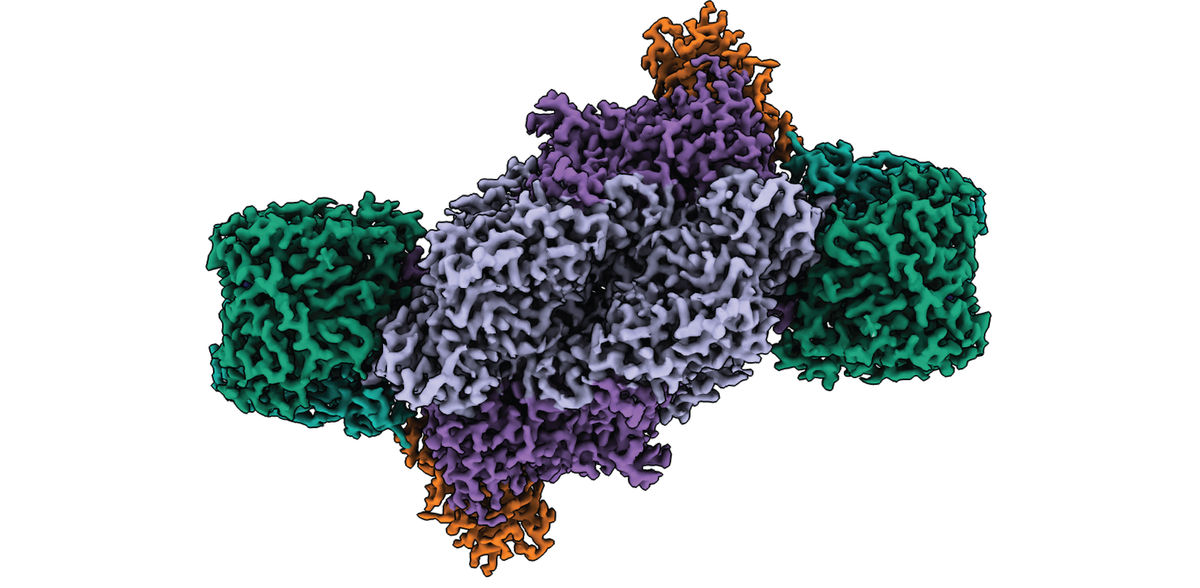
Nitrogenasen sind die einzigen biologischen Katalysatoren (Enzyme), die in der Lage sind, Stickstoff aus der Luft in bioverfügbaren Stickstoff umzuwandeln - ein Prozess, der für alles Leben auf der Erde unerlässlich ist. Nun ist es Forschenden des Max-Planck-Instituts für terrestrische Mikrobiologie in Marburg mit Hilfe der Kryo-Elektronenmikroskopie gelungen, die Struktur des Eisen-Nitrogenase-Komplexes in seiner Gesamtheit aufzuklären und seine einzigartige molekulare Architektur zu enthüllen. Die Ergebnisse bilden eine wichtige Grundlage für das Verständnis der Struktur-Funktionsbeziehungen des Enzyms und zukünftige Entwicklungen neuer Biokatalysatoren für nachhaltige Biotechnologie.
Stickstoff ist Bestandteil vieler wichtiger Biomoleküle, wie der DNA, aber auch der Aminosäuren, aus denen Proteine aufgebaut sind. Bevor Stickstoff in Biomoleküle eingebaut werden kann, muss er zunächst bioverfügbar gemacht werden. In der Natur ist nur eine einzige Klasse von Enzymen, sogenannte Nitrogenasen, in der Lage, diese wichtige Umwandlung durchzuführen.
Nitrogenasen können auch CO2 umwandeln
Kürzlich wurde gezeigt, dass Nitrogenasen auch Kohlendioxid (CO2) und Kohlenmonoxid zu Kohlenwasserstoffen wie Methan oder Ethylen reduzieren können, was prinzipiell die Möglichkeit eröffnet, Kohlenstoffabfälle in Kohlenwasserstoffprodukte umzuwandeln. Innerhalb der Familie der Nitrogenasen ist die Eisen(Fe)-Nitrogenase das Isoenzym mit der höchsten natürlichen Fähigkeit zur CO2-Reduktion. Die molekulare Architektur, die diese Reaktionen ermöglicht, war bislang jedoch unbekannt - ein Problem, das die Arbeitsgruppe von Dr. Johannes Rebelein am Max-Planck-Institut für terrestrische Mikrobiologie lösen wollte.
Die Forschenden nutzten eine gentechnisch veränderte Variante des Purpurbakteriums Rhodobacter capsulatus als Modellorganismus, um die Fe-Nitrogenase zu reinigen und biochemisch zu charakterisieren. Durch die Kombination von anaerober Biochemie und kryogener Elektronenmikroskopie in Zusammenarbeit mit der Central Electron Microscopy Facility am Max-Planck-Institut für Biophysik in Frankfurt gelang es ihnen, die Struktur des gesamten Enzymkomplexes aufzuklären.
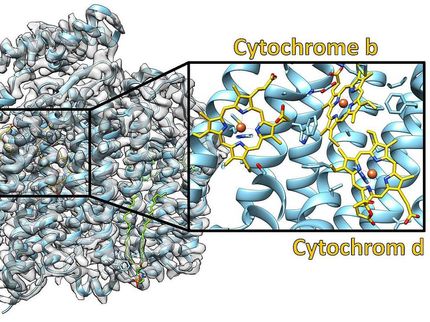
Die Ergebnisse zeigen, dass der Cofaktor im aktiven Zentrum - im Gegensatz zu anderen Nitrogenase-Typen - kein anderes Metall als Eisen enthält. Außerdem weist die Architektur der Fe-Nitrogenase besondere strukturelle Merkmale auf, die für die einzigartigen katalytischen Eigenschaften der Fe-Nitrogenase verantwortlich sein könnten.
Unterschiede jenseits des aktiven Zentrums
"Wir hatten erwartet, dass der Hauptunterschied zwischen der Fe-Nitrogenase und anderen Nitrogenase-Formen, wie der Molybdän-Nitrogenase, in der Architektur des Cofaktors im aktiven Zentrum und seiner unmittelbaren Umgebung liegt. Zu unserer Überraschung stellten wir jedoch fest, dass die aktiven Zentren der drei Nitrogenase-Isoformen, trotz ihrer Unterschiede in den katalytischen Eigenschaften, einander sehr ähnlich sind", sagt Frederik Schmidt, Doktorand im Labor von Johannes Rebelein und Erstautor der Studie. Wenn es aber keine auffälligen Unterschiede im Bereich des aktiven Zentrums gibt, welche Merkmale könnten dann die einzigartige Reaktivität dieses Enzyms erklären?
Die Autorinnen und Autoren weisen auf zwei strukturelle Besonderheiten hin: Zum einen besitzt das Enzym eine zusätzliche Untereinheit, die so genannte G-Untereinheit. Diese Untereinheit war zwar schon früher beschrieben worden, ihre Funktion blieb jedoch rätselhaft. Basierend auf ihrer neuen Struktur schlagen die Forschenden drei mögliche Funktionen für die G-Untereinheit vor, nämlich die Koordination des Elektronentransfers, die Kanalisierung des Substrats und die Stabilisierung des Cofaktors im aktiven Zentrum.
Veränderte Symmetrie könnte Grund für höhere Reaktivität sein
Nitrogenasen sind Enzyme, deren Funktion durch die Interaktion zweier symmetrischer Hälften zustande kommt. Als die Forschenden jedoch die Struktur der Fe-Nitrogenase mit der bereits gelösten Struktur der Mo-Nitrogenase überlagerten, stellten sie fest, dass bei letzterer die Symmetrie verändert ist. "Man nimmt an, dass die beiden symmetrischen Hälften miteinander kommunizieren, um den katalytischen Mechanismus des Enzyms zu koordinieren. Die veränderte Symmetrie, die wir in der Fe-Nitrogenase beobachtet haben, könnte ihre besondere Reaktivität erklären,“ erklärt Luca Schulz, Mit-Erstautor der Studie.
Wie genau diese strukturellen Unterschiede den katalytischen Mechanismus der Fe-Nitrogenase beeinflussen, wird eine der Schlüsselfragen für die Zukunft sein. Die Forscher hoffen, den molekularen Mechanismus des Enzyms weiter aufklären zu können, was zur Entwicklung neuartiger Biokatalysatoren für die nachhaltige Stickstoffassimilation und CO2-Umwandlung beitragen könnte.