Bauplan eines bakteriellen Kraftwerks entschlüsselt
Interessantes Ziel für neuartige Antibiotika
Wissenschaftler der Universität Würzburg und der Universität Freiburg gelang es die komplexe molekulare Struktur des bakteriellen Enzyms Cytochrom-bd-Oxidase zu entschlüsseln. Da Menschen diesen Typ der Oxidase nicht besitzen, könnte dieses Enzym ein interessantes Ziel für neuartige Antibiotika sein.
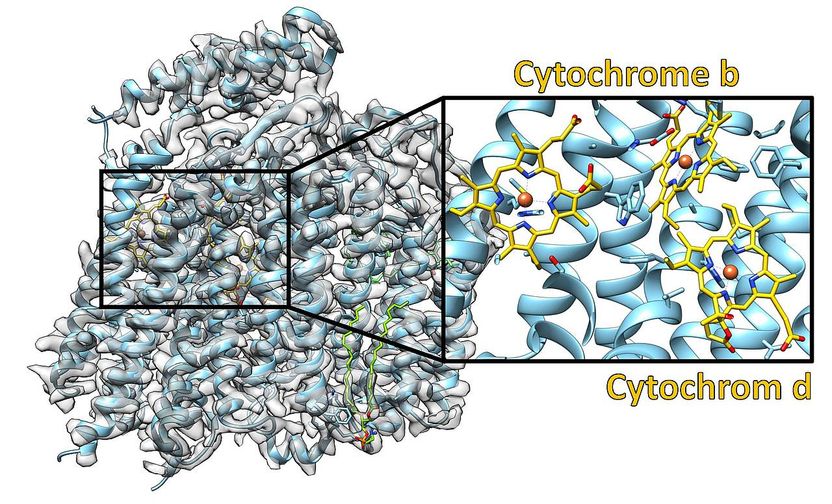
Struktur der Cytochrom-bd-Oxidase. Die experimentellen Daten sind in grau dargestellt und das daraus abgeleitete molekulare Modell farbig. Die Ausschnittvergrößerung zeigt den Bereich, in dem die drei Cytochrome gebunden sind.
Rudolf-Virchow-Zentrum, Universität Würzburg
Sowohl Menschen als auch viele andere Lebewesen brauchen Sauerstoff zum Überleben. Bei der Umsetzung von Nährstoffen in Energie wird der Sauerstoff zu Wasser umgewandelt, wofür das Enzym Oxidase verantwortlich ist. Es stellt den letzten Schritt der sogenannten Atmungskette dar.
Energiegewinnung mit Hilfe des Enzyms Oxidase
Während Menschen nur einen Typ dieser Oxidasen besitzen, hat der bakterielle Modellorganismus Escherichia coli (E. coli) drei alternative Enzyme zur Verfügung. Um besser zu verstehen, warum E. coli und andere Bakterien mehrere Oxidasen brauchen, haben Prof. Bettina Böttcher vom Rudolf-Virchow-Zentrum in Zusammenarbeit mit Prof. Thorsten Friedrich (Universität Freiburg) die molekulare Struktur der Cytochrom-bd-Oxidase aus E. coli aufgeklärt. Diesen Typ von Oxidasen findet man nur in Bakterien und den mikrobiellen Archaeen.
Bakterien besitzen andere Typen von Oxidasen
Die namengebenden Cytochrome, zwei vom Typ b und eines vom Typ d, sind die entscheidenden eisenhaltigen Gruppen, die der Oxidase ihre Funktion verleihen. Am Cytochrom d wird der Sauerstoff gebunden und zu Wasser umgesetzt. Bei der Strukturaufklärung stellte sich heraus, dass die Architektur der Cytochrom-bd-Oxidase aus E. coli sehr ähnlich der Struktur aus einem anderen Bakterium ist, Geobacillus thermodenitrificans. „Zu unserer großen Überraschung zeigte sich jedoch, dass ein Cytochrom b und das Cytochrom d die Positionen gewechselt haben und damit den Ort der Sauerstoffumsetzung innerhalb des Enzyms“, berichtet Prof. Thorsten Friedrich.
Die Ursache für diesen Wechsel könnte sein, dass die Cytochrom-bd-Oxidase eine zweite Funktion erfüllen kann: Neben der Energiegewinnung kann es zum Schutz gegen oxidativen Stress und Stress durch Nitroxide dienen. Besonders pathogene Bakterienstämme zeigen eine hohe Aktivität der Cytochrom-bd-Oxidase. Da Menschen diesen Typ der Oxidase nicht besitzen, könnten diese Ergebnisse einen wichtigen Hinweis auf die Entwicklung neuer antimikrobieller Wirkstoffe liefern, die auf die Cytochrom-bd-Oxidase von Krankheitserregern wie Mykobakterien abzielen.
Maßgeblich für den Erfolg war das neue Hochleistungselektronenmikroskop, das seit 2018 unter der Leitung von Prof. Böttcher am Rudolf-Virchow-Zentrum betrieben wird. „Die Cytochrom-bd-Oxidase stellte eine anspruchsvolle Probe für die Kryo-Elektronenmikroskopie dar, weil es eines der kleinsten Membranproteine ist, dessen Struktur mit dieser Technik bisher aufgeklärt wurde“, erklärt Prof. Bettina Böttcher.
Besonderheiten dieser Technik sind extrem tiefe Temperaturen bis zu minus 180 Grad Celsius und eine Auflösung, die sich in der Größenordnung von Atomen bewegt. Sie ermöglicht es, biologische Moleküle und Komplexe in Lösung zu untersuchen, die zuvor schockgefroren wurden, und deren dreidimensionale Struktur zu rekonstruieren. Mit einer Spannung von 300.000 Volt beschleunigt das Mikroskop die Elektronen, mit denen es die Proben „abtastet“.
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
Alexander Theßeling#, Tim Rasmussen#, Sabrina Burschel, Daniel Wohlwend, Jan Kägi, Rolf Müller, Bettina Böttcher* and Thorsten Friedrich*; "Homologous bd oxidases share the same architecture but differ in mechanism"; Nature Communications; Nov 2019
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.



















































