Fujirebio Diagnostics und Abbott vereinbaren Entwicklung eines neuen Tests zur Erkennung von Eierstockkrebs
Test könnte Ärzten helfen, wirksame Behandlungsoptionen früher zu identifizieren
Fujirebio Diagnostics, Inc. und Abbott haben eine Lizenzvereinbarung über die Entwicklung eines neuen Tests zur Erkennung von Eierstockkrebs unterzeichnet. Die Tests sind für den Einsatz mit den automatisierten diagnostischen ARCHITECT(R)-Analysegeräten Abbotts vorgesehen. Im Rahmen der Vereinbarung entwickelt und produziert Fujirebio Diagnostics für Abbott einen einfachen Bluttest für den Biomarker HE4, der die Risikostratifizierung von Frauen mit hohem Eierstockkrebsrisiko unterstützen könnte. Die frühzeitige Erkennung dieser Krankheit stellt die Medizin bis heute vor große Schwierigkeiten.
"Die Medizinbranche hat die Öffentlichkeit zwar mit Warnsignalen und Symptomen von Eierstockkrebs vertraut gemacht - der Schlüssel zur Bekämpfung dieser tödlichen Krankheit liegt jedoch in besseren Hilfsmitteln und Technologien zur frühzeitigen Erkennung", sagte Olle Nilsson, Ph.D., Vice President und Chief Scientific Officer von Fujirebio Diagnostics. "Mit dem HE4-Test, dessen Verfügbarkeit für 2009 erwartet wird, wird Abbott Ärzten in aller Welt über das ARCHITECT-System ein Instrument bieten, das dabei helfen kann, Raumforderungen im Beckenbereich zu definieren, so dass die optimalen Behandlungsoptionen früher und wirksamer bestimmt werden können."
In der manuellen Ausführung ist HE4 derzeit von der FDA zur Beobachtung von Patienten mit rezidivierendem bzw. fortschreitendem epithelialen Eierstockkrebs (EOC) zugelassen und hat in Europa die CE-Zulassung als Hilfsmittel zur Risikobewertung von EOC bei prämenopausalen oder postmenopausalen Frauen mit Raumforderungen im Beckenbereich erhalten. Der manuelle HE4-Test und der zugehörige Algorithmus zur Bestimmung des Malignitätsrisikos (Risk of Ovarian Malignancy Algorithm - ROMA(TM)) für den Einsatz bei Frauen mit Raumforderungen im Beckenbereich warten derzeit auf die Zulassung durch die FDA.
"Ärzte stellen jedes Jahr bei mehr als 250.000 Frauen verdächtige Raumforderungen im Beckenbereich fest. Dennoch gibt es bis heute kein zuverlässiges Hilfsmittel, um eine maligne Erkrankung von anderen gutartigen gynäkologischen Befunden zu unterscheiden", sagte Robert Doss, Ph.D., Divisional Vice President, Research and Development, bei Abbott Diagnostics.. "HE4 stellt einen bedeutenden Marker für die Auswertung dieser Raumforderungen im Beckenbereich dar, und wir freuen uns darüber, mit Fujirebio Diagnostics an der Entwicklung eines Tests für das ARCHITECT-System zusammenzuarbeiten."
Meistgelesene News
Organisationen
Weitere News aus dem Ressort Forschung & Entwicklung

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte

Alexandra Gatzemeyer wird in den Vorstand der Sartorius AG berufen und übernimmt die Leitung der Sparte Lab Products & Services
LaVision BioTec erwirbt Unterlizenzen von Carl Zeiss
Forschen an der Grenze
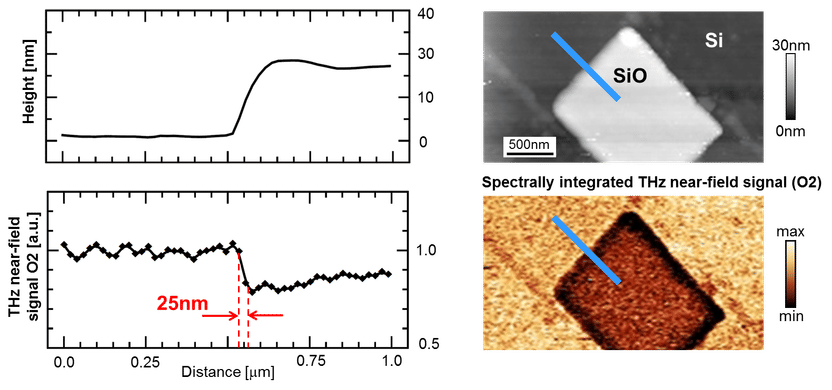
Terahertz goes Nano: Hochauflösende Terahertz-Nahfeld-Mikroskopie

Kühe kochen nicht - Lebensmittelchemiker entwickeln neues Analyseverfahren zum Nachweis von Bio-Milch

Einfacher Nasenabstrich kann Frühwarnung vor neu auftretenden Viren liefern - Ein Test auf ein einzelnes Molekül des Immunsystems kann helfen, heimliche Viren aufzuspüren, die in Standardtests nicht erkannt werden
Junge Nanotechnologen wollen neuartige Chipstrukturen erforschen - Neue Helmholtz-Nachwuchsgruppen in Jülich

Neue Methode für schnelle 3D-Mikroskopie - Vorhandene Mikroskope aufrüsten
Verfolgung der Chiralität in Echtzeit - "Diese bahnbrechenden Experimente zeigen, dass der zeitaufgelöste Zirkulardichroismus in einzigartiger Weise geeignet ist, die molekularen Bewegungen zu erfassen, die viele (bio)chemische Prozesse antreiben"
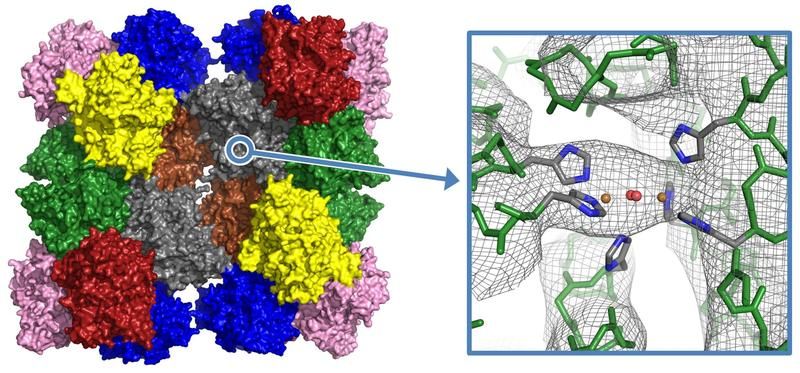
Blaues Blut des Kaiserskorpions durchleuchtet - Mainzer Biologen gelingt erstmals die Kristallisation vom Hämocyanin des Kaiserskorpions