Vereinfachte Methode zur Kalibrierung optischer Pinzetten
Breitbandige Messung der Viskoelastizität mit reduzierter Messzeit
Messungen der biomechanischen Eigenschaften im Inneren lebender Zellen erfordern minimalinvasive Methoden. Besonders attraktiv ist die optische Pinzette als Werkzeug. Sie nutzt den Impuls von Licht, um mikro- oder nanoskalige Partikel einzufangen und zu manipulieren. Ein Forscherteam um Prof. Dr. Cornelia Denz vom Institut für Angewandte Physik der Westfälischen Wilhelms-Universität (WWU) Münster hat nun eine vereinfachte Methode entwickelt, um die nötige Kalibrierung der optischen Pinzette in dem zu untersuchenden System vorzunehmen. Beteiligt waren auch Wissenschaftler der Universität Pavia in Italien. Die Ergebnisse der Studie wurden in der Fachzeitschrift "Scientific Reports" veröffentlicht.
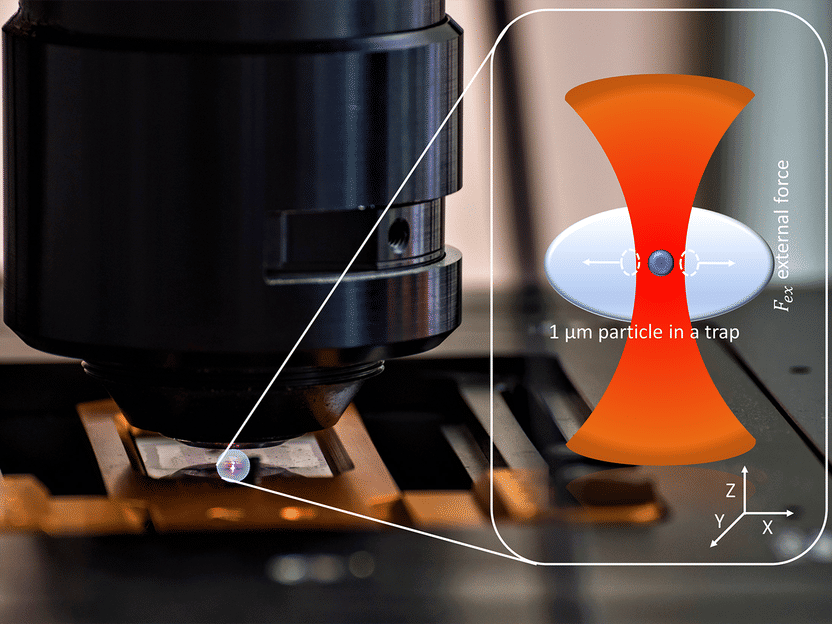
Ein Mikropartikel, der mit einer optischen Pinzette festgehalten wird, unter dem Mikroskop. Rechts im Bild: Illustration des festgehaltenen Partikels (vergrößert); rot dargestellt ist das Licht des eingesetzten Infrarotlasers.
Pascal Runde
Die Kalibrierung sorgt dafür, dass Messungen unterschiedlicher Proben und mit verschiedenen Geräten vergleichbar sind. Eine der vielversprechendsten Techniken zur Kalibrierung optischer Pinzetten ist die sogenannte Aktiv-Passiv-Kalibrierung. Dabei wird die Verformbarkeit der Probe und die Kraft der optischen Pinzette bestimmt. Das Forscherteam hat dieses Verfahren nun weiter verbessert, sodass sich die Messzeit auf wenige Sekunden verkürzt. Die optimierte Methode bietet damit die Möglichkeit, dynamische Prozesse lebender Zellen zu charakterisieren. Diese können mit längeren Messungen nicht untersucht werden, da sich die Zellen während der Messung selbst reorganisieren und ihre Eigenschaften verändern. Darüber hinaus hilft die Verkürzung der Messzeit dabei, das Risiko einer Beschädigung der biologischen Proben durch lichtbedingte Erwärmung zu verringern.
Das Kalibrierung funktioniert, vereinfacht gesagt, wie folgt: Die mikro- oder nanometergroßen Partikel werden in eine viskoelastische Probe eingebettet, die auf dem Tisch eines Mikroskops gehalten wird (viskoelastische Materialien haben Eigenschaften von Feststoffen und Flüssigkeiten: elastisch und viskos). Durch schnelle, präzise Verschiebungen des Probenträgers im Nanometerbereich wird das optisch eingefangene Partikel in Schwingungen versetzt. Durch die Messung des gebrochenen Laserlichts können Positionsänderungen der Probe aufgezeichnet und auf diese Weise Rückschlüsse auf ihre Eigenschaften, zum Beispiel die Steifigkeit, gezogen werden. Dies geschieht üblicherweise nacheinander bei unterschiedlichen Schwingungsfrequenzen. Das Team um Cornelia Denz und Randhir Kumar, Doktorand in der münsterschen Arbeitsgruppe, führte die Messung nun bei mehreren Frequenzen gleichzeitig für einen breiten Frequenzbereich durch. Diese Mehrfrequenzmethode führt zu einer verkürzten Messzeit. Als Proben setzten die Wissenschaftler Lösungen von Methylcellulose in Wasser in verschiedenen Konzentrationen ein. Diese haben eine ähnliche Viskoelastizität wie lebende Zellen.
Zum Hintergrund: Biomechanische Eigenschaften wie Steifigkeit, Viskosität und Viskoelastizität von lebenden Zellen und Geweben spielen eine entscheidende Rolle bei vielen lebenswichtigen Zellfunktionen wie Zellteilung, Zellmigration, Zelldifferenzierung und Gewebemusterung. Diese Eigenschaften lebender Zellen könnten auch als Indikator für das Fortschreiten von Krankheiten dienen. Der Beginn und die Entwicklung von Krebs beispielsweise wird typischerweise von Veränderungen der Steifigkeit, der Viskosität und der Viskoelastizität der Zellen begleitet.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.



















































