Struktur eines neuartigen Enzyms, das mit Zellwachstum und Krebs verbunden ist, geknackt
RNA, oder Ribonukleinsäure, ist in den Zellen aller Lebewesen vorhanden und wird zur Synthese von Proteinen benötigt. Ein Forschungsteam der University of California, Riverside, hat die Struktur eines neuartigen RNA-modifizierenden Enzyms, ZCCHC4, entdeckt und den Mechanismus identifiziert, der steuert, wie dieses Enzym das Substrat erkennt.
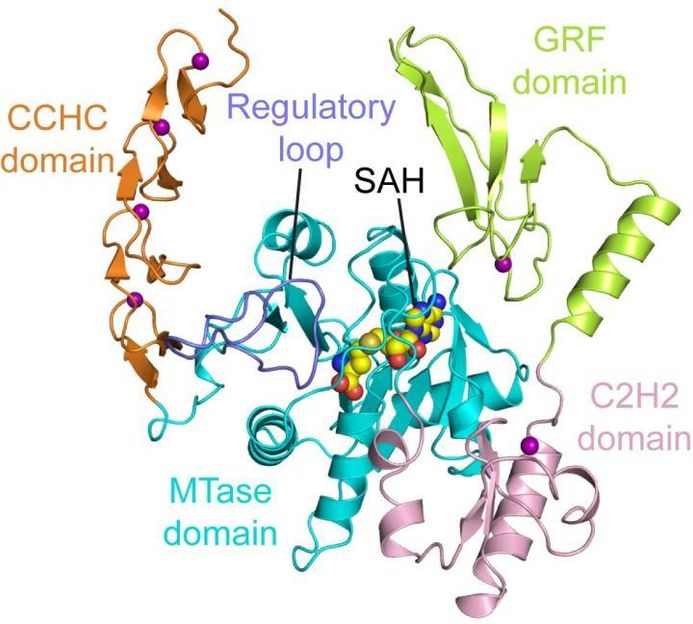
Dieses Bild zeigt die Struktur von ZCCHC4.
Song lab, UC Riverside
ZCCHC4 beeinflusst die Zellproliferation und wurde mit Krebserkrankungen in Verbindung gebracht. Es führt eine Art von RNA-Modifikation, N6-Methyladenosin (m6A), in Ribosomen ein, die Zellorganellen sind, die aus RNA-Molekülen und Protein bestehen.
Die in Nature Communications veröffentlichte Studie erklärt, wie Proteinmaschinen in Zellen reguliert werden, um RNA-Moleküle für die m6A-Modifikation zu identifizieren.
Jikui Song, ein außerordentlicher Professor für Biochemie an der UC Riverside, der die Studie leitete, erklärte, dass ZCCHC4 die Proteinsynthese und Zellproliferation durch die Einführung einer m6A-Modifikation in Ribosomen kontrolliert. ZCCHC4, fügte er hinzu, ist überexprimiert in Tumoren, die mit hepatozellulärem Karzinom assoziiert sind - der häufigsten Form von primärem Leberkrebs.
"Dies ist das erste Mal, dass jemand die Kristallstruktur von ZCCHC4 bestimmt", sagte Song. "Unsere Entdeckung kann für das strukturbasierte Wirkstoffentwurf gegen Krebs verwendet werden und führt zu einem besseren Verständnis dafür, wie m6A, eine Modifikation, die mit zahlreichen biologischen Prozessen verbunden ist, auf ribosomaler RNA installiert wird."
Die m6A-Modifikation hat in den letzten Jahren aufgrund ihrer wichtigen Rolle im RNA-Stoffwechsel und in der Biologie große Beachtung gefunden. Wie diese Modifikation dynamisch programmiert und in Zellen verteilt wird, ist jedoch noch wenig bekannt.
"Die Struktur von ZCCHC4 liefert ein Verständnis dafür, wie dieses Enzym verdrahtet ist, um spezifisch auf die ribosomale RNA 28S zu wirken," sagte Song und bemerkte, dass ein Ribosom mit unterschiedlich großen Untereinheiten aufgebaut ist. 28S ribosomale RNA bezieht sich auf die RNA-Komponente in der 28S ribosomalen Untereinheit. "Wir verstehen jetzt, dass dieses Enzym von einem autoinhibitorischen Mechanismus kontrolliert wird, der bei vielen anderen Zellprozessen beobachtet wurde."
Um die Struktur von ZCCHC4 zu knacken, produzierte Song's Team zunächst ein enzymatisch aktives und strukturell starres ZCCHC4-Fragment. Die Forscher brachten dieses Protein dann dazu, zu kristallisieren. Schließlich beugten sie die Kristalle mit Röntgenstrahlen und analysierten die Daten, was schließlich zur Entdeckung der Struktur von ZCCHC4 führte.
Im vergangenen Jahr löste Song's Labor die Kristallstruktur für ein Enzym, das eine Schlüsselrolle bei der DNA-Methylierung spielt, dem Prozess, bei dem Methylgruppen dem DNA-Molekül zugesetzt werden.
Als nächstes wird das Forschungsteam weiterhin untersuchen, wie verschiedene DNA- und RNA-Modifikationen in Zellen entstehen, was starke Auswirkungen auf Gesundheit und Krankheiten hat.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.