Der Computer als Mikroskop
Schalterproteine sind überall im Körper aktiv und häufig am Entstehen von Krankheiten beteiligt. Bochumer Forscher haben neue Einblicke in ihre Funktionsweise erlangt – dank einer besonderen Methode.

Das Forscherteam Carsten Kötting, Daniel Mann und Klaus Gerwert (von links) bereitet das Messgerät vor. Der Detektor des Spektrometers muss mit flüssigem Stickstoff gekühlt werden.
© RUB, Marquard
Mit einer Kombination aus Infrarotspektroskopie und Computersimulationen haben Forscher der Ruhr-Universität Bochum (RUB) neue Einblicke in die Funktionsweise von Schalterproteinen gewonnen. Dank hoher zeitlicher und räumlicher Auflösung belegten sie unter anderem den entscheidenden Beitrag eines Magnesiumatoms für das An- und Ausschalten der sogenannten G-Proteine.
G-Proteine sind zum Beispiel am Sehen, Riechen, Schmecken und an der Blutdruckregulation beteiligt. Sie sind Angriffspunkt für viele Medikamente. „Ein detailliertes Verständnis ihrer Funktionsweise ist daher nicht nur von akademischem Interesse“, sagt Prof. Dr. Klaus Gerwert, Leiter des Lehrstuhls für Biophysik. Er berichtet die Ergebnisse gemeinsam mit seinen Bochumer Kollegen Privatdozent Dr. Carsten Kötting und Daniel Mann im Biophysical Journal.
G-Proteine als Krankheitsquelle
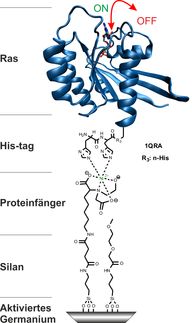
An alle G-Proteine kann das Molekül GTP binden. Spaltet ein Enzym eine Phosphatgruppe vom gebundenen GTP ab, wird das G-Protein ausgeschaltet. Diese sogenannte GTP-Hydrolyse läuft innerhalb von Sekunden im aktiven Zentrum der Enzyme ab. Funktioniert der Prozess nicht, kann das schwere Krankheiten auslösen, etwa Krebs, Cholera oder das seltene McCune-Albright-Syndrom, das sich zum Beispiel durch einen gestörten Knochenstoffwechsel auszeichnet.
Magnesium wichtig für Schaltmechanismus
Damit die GTP-Hydrolyse stattfinden kann, muss ein Magnesiumatom im aktiven Zentrum des Enzyms vorhanden sein. Das Forscherteam beobachtete erstmals direkt, wie das Magnesium Geometrie und Ladungsverteilung seiner Umgebung beeinflusst. Nach dem Ausschalten verbleibt das Atom in der Bindetasche des Enzyms. Bislang waren Forscher davon ausgegangen, dass das Magnesium die Tasche nach dem Schaltprozess verlässt.
Möglich machte die Erkenntnisse eine am RUB-Lehrstuhl für Biophysik entwickelte Methode. Sie erlaubt, enzymatische Prozesse mit hoher zeitlicher und räumlicher Auflösung in ihrem natürlichen Zustand zu verfolgen. Es handelt sich dabei um eine besondere Form der Spektroskopie, die zeitaufgelöste Fourier-Transform-Infrarot-Differenzspektroskopie. Allerdings geben die damit gemessenen Daten keine Auskunft darüber, an welcher Stelle des Enzyms ein Prozess gerade stattfindet. Diese Information gewinnen die Forscher durch quantenmechanische Computersimulationen von Strukturmodellen. „Erst mithilfe der Computersimulation können wir die in den Infrarotspektren versteckten Informationen decodieren“, erklärt Carsten Kötting. So wird der Computer quasi zum Mikroskop.
Wie Proteine das Ausschalten beschleunigen
In der aktuellen Studie zeigten die RUB-Biophysiker auch, wie das spezialisierte Proteinumfeld dazu beiträgt, die GTP-Hydrolyse zu beschleunigen. Sie untersuchten die Rolle der Aminosäure Lysin, die in vielen G-Proteinen an der gleichen Stelle positioniert ist. Sie bindet genau die Phosphatgruppe des GTP-Moleküls, von der beim Ausschalten des G-Proteins ein Phosphat abgespalten wird.
„Lysin hat die Aufgabe, negative Ladungen von der dritten Phosphatgruppe auf die zweite Phosphatgruppe zu übertragen und damit die GTP-Hydrolyse zu beschleunigen“, erklärt Daniel Mann. „Das ist ein weiterer wichtiger Ansatzpunkt, um langfristig Medikamente gegen Krebs und andere schwerwiegende Erbkrankheiten zu entwickeln.“
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!