Pharmaka mit Zuckerketten
Native Top-Down-Massenspektrometrie beleuchtet Rolle von Glykanen bei Proteinoligomeren
Viele Proteine tragen Muster aus Zuckermolekülen (Glykane) und bestehen aus mehreren aggregierten Untereinheiten. Diese Glycolisierung bzw. Oligomerisierung beeinflussen die Proteinfunktion entscheidend und sind für Biopharmaka zu berücksichtigen. In der Zeitschrift Angewandte Chemie stellt ein britisches Team einen Ansatz auf Basis der sog. nativen top-down Massenspektrometrie (MS) vor, mit dem sie das Zusammenspiel zwischen Glykosylierung und Oligomerisierung für verschiedene therapeutische Hormone und Cytokine analysierten.
(c) Wiley-VCH
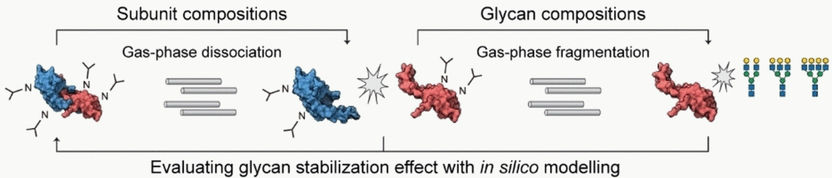
Während bei der konventionellen MS Moleküle in Bruchstücke zerfallen, ermöglicht die native MS die Untersuchung gefalteter Protein-Oligomere mit gebundenen Glykanen. Beim top-down-Ansatz werden im nächsten Schritt die Oligomere durch eine Gasphasendissoziation getrennt und gemessen. Im letzten Schritt können per Gasphasenfragmentierung die Glykane abgespalten und analysiert werden. So lässt sich für einen Protein-Komplex feststellen, in welchen Mengenverhältnissen Monomere und Oligomere – im Organismus bzw. in einer Charge eines Wirkstoffs – vorliegen und welche unterschiedlichen Glykosylierungsmuster in welchen Mengen auftreten.
Carol V. Robinson und Di Wu von der Universität Oxford (Großbritannien) konzentrierten sich auf Glykane, die an der Grenzfläche zwischen zwei Untereinheiten lokalisiert sind und eine wichtige Rolle für die Oligomerisierung spielen könnten. Sie verglichen ihre Messergebnisse mit einem theoretischen Modell, das ausgehend von den dissoziierten Untereinheiten berechnet wurde. So waren Rückschlüsse auf den Stabilisierungseffekt der Glykane möglich.
Zu den untersuchten therapeutischen Glykoproteinen zählte Interferon-β (IFN-β), ein entzündungshemmendes Cytokin, das z.B. gegen Multiple Sklerose verabreicht wird. IFN-β1a bildet ein asymmetrisches Homodimer. Die MS-Analysen ergaben, dass die meisten Hauptformen des Monomers sowie des Dimers glykolsyliert vorliegen. Die Dimerisierung ist für dieses Cytokin jedoch unabhängig vom Glykosylierungsstatus.
Anders beim Tumornekrose-Faktor-α (TNF-α), einem entzündungsfördernden Cytokin. Antikörper-basierte Biopharmaka, die TNF-α neutralisieren, werden bei Autoimmunerkrankungen, z.B. rheumatischer Arthritis, Morbus Crohn und Schuppenflechte, eingesetzt. TNF-α ist ein Homotrimer mit einem Glykan an der Grenzfläche jeder Untereinheit. Die MS-Analysen sowie Versuche mit einem kleinen Molekül, das die Trimerisierung stört, ergaben, dass die Glykane das TNF-α-Trimer erheblich stabilisieren.
Zudem untersuchten Robinson und Wu das Follikel-stimulierende Hormon (FSH, Follitropin), ein Heterodimer aus α- und β-Untereinheit. Follitropin α-basierte Wirkstoffe werden für Fruchtbarkeitsbehandlungen eingesetzt. Auf der α-Untereinheit entdeckte das Team eine außergewöhnliche Verteilung von Glykanen. Eines dieser Glykane wechselwirkt ausgiebig mit der β-Untereinheit und ist offenbar an der Regulation der Dimerisierung beteiligt.
Der Erkenntnisgewinn aus nativen top-down MS-Ansätzen könnte helfen, die Glykane therapeutischer Proteine maßzuschneidern und so deren Stabilität und Effizienz zu verbessern.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Massenspektrometrie
Die Massenspektrometrie ermöglicht es uns, Moleküle aufzuspüren, zu identifizieren und ihre Struktur zu enthüllen. Ob in der Chemie, Biochemie oder Forensik – Massenspektrometrie eröffnet uns ungeahnte Einblicke in die Zusammensetzung unserer Welt. Tauchen Sie ein in die faszinierende Welt der Massenspektrometrie!
Themenwelt Massenspektrometrie
Die Massenspektrometrie ermöglicht es uns, Moleküle aufzuspüren, zu identifizieren und ihre Struktur zu enthüllen. Ob in der Chemie, Biochemie oder Forensik – Massenspektrometrie eröffnet uns ungeahnte Einblicke in die Zusammensetzung unserer Welt. Tauchen Sie ein in die faszinierende Welt der Massenspektrometrie!


















































