Neue Technik zeigt im Detail, wo Medikamentenmoleküle im Körper ihre Ziele treffen
Die neue Methode könnte die Entwicklung vieler neuer Medikamente beschleunigen
Wissenschaftler von Scripps Research haben eine Methode entwickelt, mit der sich gewebeübergreifend und mit größerer Präzision als je zuvor abbilden lässt, wo Medikamente im Körper an ihre Ziele binden. Die neue Methode könnte zu einem Routineinstrument in der Arzneimittelentwicklung werden.
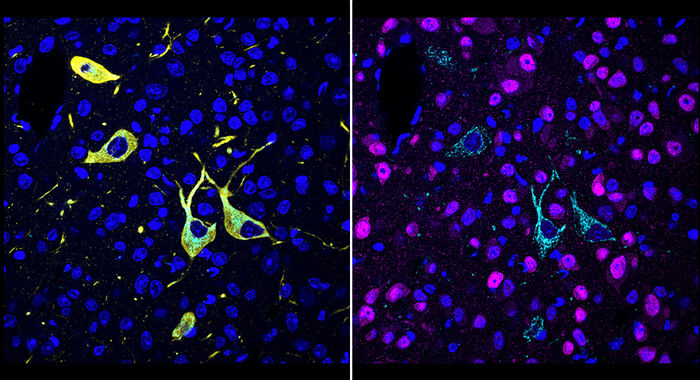
Ein Team von Scripps Research hat eine neue Methode namens CATCH entwickelt, die zeigt, wie Medikamente ihre Ziele im Körper erreichen. Zellen, auf die ein Medikament abzielt (Pargyline in Cyan), können durch mehrere Runden der Immunmarkierung identifiziert werden (rot: Neuronen; gelb: dopaminerge/noradrenerge Neuronen; blau: Zellkerne).
Scripps Research
Bei der neuen Methode, die am 27. April 2022 in der Zeitschrift Cell beschrieben wurde, werden fluoreszierende Markierungen an Arzneimittelmoleküle angehängt und chemische Verfahren zur Verbesserung des Fluoreszenzsignals eingesetzt. Die Forscher demonstrierten die Methode mit mehreren verschiedenen experimentellen Medikamenten und zeigten, wo - sogar innerhalb einzelner Zellen - die Medikamentenmoleküle ihre Ziele treffen.
"Diese Methode sollte es uns letztendlich ermöglichen, zum ersten Mal relativ leicht zu erkennen, warum ein Medikament wirksamer ist als ein anderes oder warum ein Medikament eine bestimmte Nebenwirkung hat und ein anderes nicht", sagt der Hauptautor der Studie, Li Ye, PhD, Assistenzprofessor für Neurowissenschaften bei Scripps Research und Inhaber des Abide-Vividion-Lehrstuhls für Chemie und chemische Biologie.
Der Erstautor der Studie, Zhengyuan Pang, ist ein Doktorand im Labor von Ye. Die Studie war auch eine enge Zusammenarbeit mit dem Labor von Ben Cravatt, PhD, Gilula Chair of Chemical Biology bei Scripps Research.
"Das einzigartige Umfeld bei Scripps Research, in dem Biologen routinemäßig mit Chemikern zusammenarbeiten, hat die Entwicklung dieser Technik erst möglich gemacht", sagt Ye.
Zu verstehen, wo Wirkstoffmoleküle an ihre Zielmoleküle binden, um ihre therapeutischen Wirkungen - und Nebenwirkungen - auszuüben, ist ein grundlegender Bestandteil der Arzneimittelentwicklung. Für die Untersuchung der Wechselwirkungen zwischen Medikamenten und Zielmolekülen werden jedoch traditionell relativ ungenaue Methoden verwendet, wie z. B. die Massenanalyse der Konzentration von Medikamentenmolekülen in ganzen Organen.
Bei der CATCH-Methode werden winzige chemische Griffe in Arzneimittelmoleküle eingefügt. Diese winzigen chemischen Griffe reagieren mit nichts anderem im Körper, ermöglichen aber das Hinzufügen von fluoreszierenden Markierungen, nachdem die Medikamentenmoleküle an ihre Ziele gebunden haben. Da menschliches oder tierisches Gewebe dazu neigt, das Licht dieser fluoreszierenden Markierungen zu streuen und zu blockieren, kombinierten Ye und sein Team den Markierungsprozess mit einer Technik, die das Gewebe relativ transparent macht.
In dieser ersten Studie optimierten und bewerteten die Forscher ihre Methode für "kovalente Medikamente", die sich mit stabilen chemischen Bindungen, so genannten kovalenten Bindungen, irreversibel an ihre Ziele binden. Aufgrund dieser irreversiblen Bindung ist es besonders wichtig, zu überprüfen, ob solche Medikamente auch wirklich an ihrem Ziel ankommen.
Die Wissenschaftler untersuchten zunächst mehrere kovalente Hemmstoffe eines Enzyms im Gehirn, der Fettsäureamidhydrolase (FAAH). FAAH-Hemmer haben die Wirkung, den Gehalt an Cannabinoidmolekülen, einschließlich des "Glücksmoleküls" Anandamid, zu erhöhen, und werden zur Behandlung von Schmerzen und Stimmungsstörungen untersucht. Die Wissenschaftler waren in der Lage, auf Einzelzellebene abzubilden, wo diese Inhibitoren ihre Ziele in großen Mengen von Mäusegehirngewebe treffen, und konnten ihre unterschiedlichen Muster der Zielwirkung leicht unterscheiden.
In einem Experiment zeigten sie, dass ein experimenteller FAAH-Hemmer namens BIA-10-2474, der 2016 in einer klinischen Studie in Frankreich einen Todesfall und mehrere Verletzungen verursachte, unbekannte Ziele im Mittelhirn von Mäusen angreift, selbst wenn den Mäusen das FAAH-Enzym fehlt - was einen Hinweis auf die Ursache der Toxizität des Hemmers liefert.
In weiteren Tests, die die beispiellose Präzision und Vielseitigkeit der neuen Methode demonstrieren, zeigten die Wissenschaftler, dass sie die Bildgebung von Wirkstoffzielen mit separaten Fluoreszenzmarkierungsmethoden kombinieren können, um die Zelltypen zu ermitteln, an die ein Wirkstoff bindet. Außerdem konnten sie die Stellen, an denen das Medikament angreift, in verschiedenen Teilen der Neuronen unterscheiden. Schließlich konnten sie sehen, wie geringfügig unterschiedliche Dosierungen eines Medikaments oft den Grad der Zielbindung in verschiedenen Hirnregionen auffällig beeinflussen.
Die Proof-of-Principle-Studie ist erst der Anfang, wie Ye betont. Er und sein Team planen, CATCH weiterzuentwickeln, um es auch bei größeren Gewebeproben, vielleicht sogar bei ganzen Mäusen, einzusetzen. Außerdem planen sie, den grundlegenden Ansatz auf häufigere, nicht kovalent bindende Medikamente und chemische Sonden auszuweiten. Insgesamt, so Ye, sieht er die neue Methode als grundlegendes Werkzeug nicht nur für die Entdeckung von Medikamenten, sondern sogar für die Grundlagenbiologie.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.
Originalveröffentlichung
Zhengyuan Pang et al.; In situ identification of cellular drug targets in mammalian tissue; Cell; 2022


















































