Höchstauflösende Lichtmikroskopie ohne Untergrund
Deutlich bessere Bildqualität bei der Analyse dreidimensional angeordneter Moleküle und Zellstrukturen
Forscher am Karlsruher Institut für Technologie (KIT) haben ein neues Verfahren der Fluoreszenzmikroskopie entwickelt: Die STEDD-Nanoskopie (STEDD steht für „Stimulated Emission Double Depletion“) liefert nicht nur höchstaufgelöste Bilder, sondern unterdrückt auch den Untergrund. Daraus ergibt sich eine deutlich bessere Bildqualität, von der besonders die Analyse dreidimensional dicht angeordneter subzellulärer Strukturen profitiert. Die Forscher präsentieren STEDD, eine Weiterentwicklung der STED-Methode, in der Zeitschrift Nature Photonics.

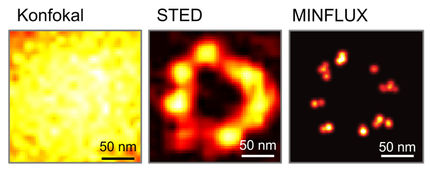
Eine Krebszelle unter dem Mikroskop: Das STED-Bild (links) weist einen niedrig aufgelösten Untergrund auf; beim STEDD-Bild (rechts) ist der Untergrund unterdrückt, sodass die Strukturen besser zu erkennen sind.
APH/KIT
Lichtoptische Mikroskopie stellt in den modernen Lebenswissenschaften eine essenzielle Methode dar. Unter anderem ermöglicht sie, lebende Zellen minimalinvasiv zu untersuchen. Konventionelle Lichtmikroskopie hat allerdings eine auf die halbe Wellenlänge des Lichts – etwa 200 Nanometer – begrenzte Auflösung, sodass feinste zelluläre Strukturen im Bild verschwimmen. In den vergangenen Jahren wurden verschiedene Verfahren der Nanoskopie entwickelt, welche die Beugungsgrenze überwinden und höchstaufgelöste Bilder liefern. Stefan W. Hell, Eric Betzig und William Moerner erhielten für ihre Nanoskopie-Methoden 2014 den Nobelpreis für Chemie. Nun haben Forscher am Karlsruher Institut für Technologie (KIT) die von Hell entwickelte STED (Stimulated Emission Depletion)-Nanoskopie so erweitert, dass sich der in den Bildern stets vorhandene Untergrund durch eine modifizierte Bildaufnahme effizient unterdrücken lässt. Die Bildqualität ist dadurch deutlich besser, was vor allem für die quantitative Datenanalyse von dreidimensional dicht angeordneten Molekülen und Zellstrukturen von großem Vorteil ist. In der Zeitschrift Nature Photonics präsentieren die Forscher um Professor Gerd Ulrich Nienhaus am Institut für Angewandte Physik (APH) und am Institut für Nanotechnologie (INT) des KIT das neue Nanoskopieverfahren namens STEDD (Stimulated Emission Double Depletion).
Bei der Fluoreszenzmikroskopie wird die zu untersuchende Probe mit einem stark fokussierten Lichtstrahl abgerastert, um Farbstoffmoleküle zur Aussendung von Fluoreszenzlicht anzuregen. Die Lichtquanten werden Pixel für Pixel registriert und so das Bild aufgebaut. Bei der STED-Nanoskopie wird der zum Abrastern verwendete Anregungsstrahl von einem weiteren Strahl überlappt, dem sogenannten STED-Strahl. Dessen Lichtintensität liegt ringförmig um den Anregungsstrahl herum; im Zentrum ist sie null. Außerdem ist der STED-Strahl zu größeren Wellenlängen hin verschoben. Der STED-Strahl nutzt einen von Albert Einstein vor 100 Jahren erstmals beschriebenen physikalischen Effekt, die stimulierte Emission, um die Fluoreszenzanregung überall abzuschalten – außer im Zentrum, wo der STED-Strahl keine Intensität besitzt. Dadurch wird die Anregung eingeschnürt, und es entsteht ein schärferer Lichtfleck für die Rasterung. Allerdings gibt es in dem hochaufgelösten STED-Bild stets einen niedrig aufgelösten Untergrund, der zum einen durch unvollständiges Abschalten, zum anderen durch Fluoreszenzanregung durch den STED-Strahl selbst verursacht wird.
Die Forschergruppe um Professor Gerd Ulrich Nienhaus hat die STED-Methode um einen zweiten STED-Strahl erweitert. Dieser STED2-Strahl folgt dem STED-Strahl zeitverzögert und löscht das im Zentrum vorhandene Nutzsignal aus, sodass nur noch die Untergrundanregung übrig bleibt. „Beim STEDD-Verfahren werden zwei Bilder aufgenommen“, erklärt Nienhaus. „Zum ersten und zum zweiten Bild tragen jeweils Photonen bei, die vor beziehungsweise nach dem Eintreffen des STED2-Strahls registriert werden.“ Durch gewichtete Differenzbildung wird das zweite Bild, das nur Untergrund enthält, vom ersten Bild, das Nutzsignal plus Untergrund enthält, Pixel für Pixel abgezogen. Ergebnis ist ein höchstaufgelöstes, untergrundfreies Bild.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Fluoreszenzmikroskopie
Die Fluoreszenzmikroskopie hat die Life Sciences, Biotechnologie und Pharmazie revolutioniert. Mit ihrer Fähigkeit, spezifische Moleküle und Strukturen in Zellen und Geweben durch fluoreszierende Marker sichtbar zu machen, bietet sie einzigartige Einblicke auf molekularer und zellulärer Ebene. Durch ihre hohe Sensitivität und Auflösung erleichtert die Fluoreszenzmikroskopie das Verständnis komplexer biologischer Prozesse und treibt Innovationen in Therapie und Diagnostik voran.
Themenwelt Fluoreszenzmikroskopie
Die Fluoreszenzmikroskopie hat die Life Sciences, Biotechnologie und Pharmazie revolutioniert. Mit ihrer Fähigkeit, spezifische Moleküle und Strukturen in Zellen und Geweben durch fluoreszierende Marker sichtbar zu machen, bietet sie einzigartige Einblicke auf molekularer und zellulärer Ebene. Durch ihre hohe Sensitivität und Auflösung erleichtert die Fluoreszenzmikroskopie das Verständnis komplexer biologischer Prozesse und treibt Innovationen in Therapie und Diagnostik voran.