Synchronschwimmer unter dem Mikroskop
Nicht nur Vögel, Fische und sogar Menschenmengen zeigen kollektive Bewegungsmuster, auch schwimmende Bakterien bilden Ströme und Wirbel, wenn ihre Zelldichte eine bestimmte Größe übersteigt. Forscher des Max-Planck-Instituts für terrestrische Mikrobiologie in Marburg analysieren, wie sich solche Muster bilden können.

Kollektive Bewegung in Bakteriensuspensionen. Rechts: Typische Momentaufnahme des Geschwindigkeitsfeldes, gemessen in einer hochdichten Zellsuspension.
© Max Planck Institute for terrestrial Microbiology/Colin
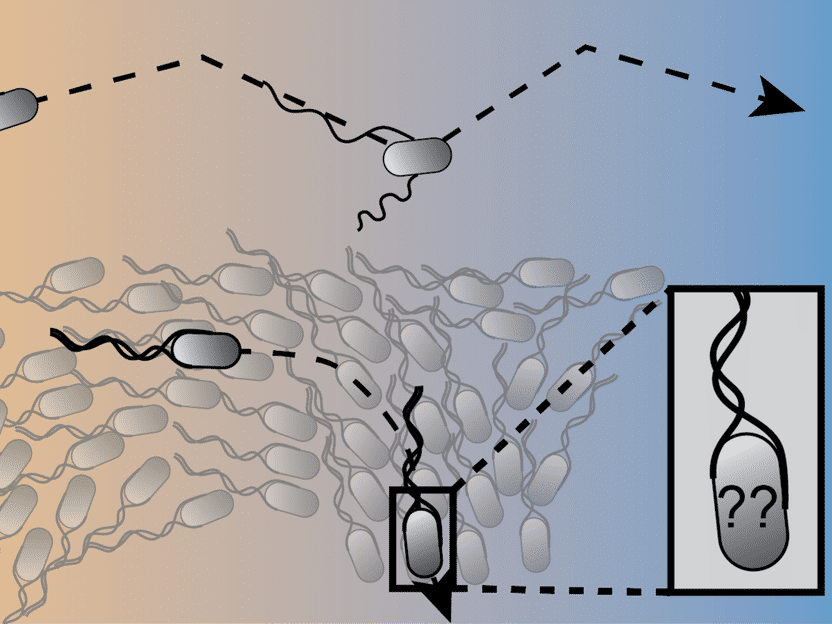
Kollektive Effekte beeinträchtigen die chemotaktische Navigation in der Umwelt. Während Bakterien in der Isolation durchaus in der Lage sind, physikalisch-chemische Gradienten zu messen und sich zu orientieren, verhindern kollektive Umorientierungen bei hoher Zelldichte die Erfüllung dieser lebenswichtigen Zellfunktion.
© Max Planck Institute for terrestrial Microbiology/Colin

Einzelne Bakterienzellen bewegen sich in relativ geraden Strecken vorwärts, unterbrochen durch kurze Umorientierungen (Taumeln). Beim Schwimmen messen die Bakterien mit einem minimalen Geruchssinn die Veränderungen ihrer chemischen Umwelt (z.B. der Nährstoffkonzentration) und verändern ihr Schwimmverhalten. Durch Verlängern der Läufe in Richtung günstiger und Verkürzen in Richtung ungünstiger Bedingungen finden sie ihren Weg zu den besseren Lebensbedingungen. Das Proteinnetzwerk, das dieses chemotaktische Verhalten steuert, ist eines der am besten untersuchten biologischen Signalverarbeitungssysteme. Über ein chemisch kodiertes Kurzzeitgedächtnis vergleicht das Bakterium die aktuellen Bedingungen mit denen, die einige Sekunden zuvor erlebt wurden, und entscheidet danach, Läufe zu verlängern oder zu verkürzen.
Obwohl die Chemotaxis typischerweise als Einzelzellverhalten gesehen wird, führt sie auch zu kollektiven Verhaltensweisen: bei lokaler Zusammenlagerung oder Wanderung in Form von Bändern führt die chemotaktische Reaktion auf selbst erzeugte Gradienten von Lockstoffen zu einer erhöhten lokalen Zelldichte.
In dichten Populationen überwiegt kollektive Bewegung
Erreicht die gesamte Zelldichte einen bestimmten Punkt, zeigt sich eine grundsätzlich andere Dynamik: Bänder und Wirbel von Bakterienzellen entstehen und lösen sich wieder auf. "Trotz des häufigen Auftretens kollektiver Motilität war bislang nur sehr wenig darüber bekannt, wie physikalische Wechselwirkungen die chemotaktische Navigation der Bakterien beeinflussen,“ erklärt Projektleiter Remy Colin. Diese Wissenslücke ist zum Teil auf die Schwierigkeit zurückzuführen, die Dynamik von Zellen in einer dichten Suspension zu messen. "Glücklicherweise wurden in den letzten Jahren neue Bildanalysemethoden entwickelt oder an bakterielle Systeme angepasst", sagt Victor Sourjik, Leiter der Abteilung für Systeme und Synthetische Biologie. "Das gab uns die Möglichkeit, Intensitätsschwankungen oder Musterverschiebungen zu nutzen, um das Schwimmverhalten und die Chemotaxis in Bakterienpopulationen zu charakterisieren."
Um sowohl die kollektive Dynamik als auch die chemotaktische Reaktion von Populationen von E. coli-Zellen bei unterschiedlicher Zelldichte zu messen, analysierten die Max-Planck-Forscher das Bakterienschwimmen in kontrollierten Gradienten eines chemischen Lockstoffs mit Hilfe neuer Bildanalysemethoden.
Kollektive Neuausrichtung beeinträchtigt Chemotaxis
Die experimentellen Ergebnisse zeigten, dass die die kollektive Bewegung die Chemotaxis nach einem Maximum bei mittleren Dichten bei zunehmender Zelldichte stark reduziert. Die kollektiven Neuausrichtungen der Bakterien scheinen den chemosensorischen Mechanismus zu stören. "Während die Zelle schwimmt, überwacht sie innerhalb weniger Sekunden die Veränderung der Konzentration attraktiver chemischer Stoffe, um zu entscheiden, ob sie innehalten soll. Wenn sich in dieser Zeit die Richtung, in der die Zelle schwimmt, signifikant geändert hat, wird die bakterielle Chemotaxis ineffizient", erklärt Remy Colin. "Als wir die experimentell beobachtete kollektive Bewegung mit numerischen Simulationen verglichen, stellten wir fest, dass die Wirkung des direkten Kontaktes zwischen den Bakterien nur sekundär ist. Die wichtigste Rolle bei der Entstehung kollektiver Muster spielen die hydrodynamischen Wechselwirkungen aufgrund der Flüssigkeitsverdrängung. Diese Frage wurde unter Physikern, die sich für kollektive Verhaltensweisen interessieren, kontrovers diskutiert."
Der Einfluss der physikalischen Wechselwirkungen auf das chemotaktische Verhalten hat mehrere wichtige Konsequenzen für das Verhalten von Bakterien bei hoher Zelldichte, denn er limitiert die chemotaktische Anhäufung von Bakterien in der Nähe von Nahrungsquellen. Das sollte einerseits eine wichtige Rolle für die Ressourcenverteilung innerhalb der Bakterienpopulationen und deren Selbstorganisation spielen; andererseits wird diese grundlegende Untergrabung der Chemotaxis auch bei Zelldichten beobachtet, wie sie für das Schwärmen typisch sind. Dabei handelt es sich um eine Fortbewegungsart, die viele Bakterien nutzen, um sich schnell auf Oberflächen zu verbreiten, zum Beispiel während einer Infektion. Die neuen Ergebnisse deuten darauf hin, dass die chemotaktische Navigation innerhalb eines Schwarmes nahezu unmöglich ist ohne spezifische Gegenmechanismen – diese gilt es noch aufzudecken.


















































