Neue chemische Werkzeuge zur Modifikation und Untersuchung von Biomolekülen
Das Verständnis der Struktur und des Stoffwechsels von Zellen und lebenden Organismen ist für die Entwicklung neuer Medikamente und Diagnostika unerlässlich. Die Verfügbarkeit chemischer Werkzeuge, die es Wissenschaftlern ermöglichen, Biomoleküle, wie Proteine, mit atomarer Auflösung zu bearbeiten, hat wesentlich zum Fortschritt der chemischen Biologie beigetragen.
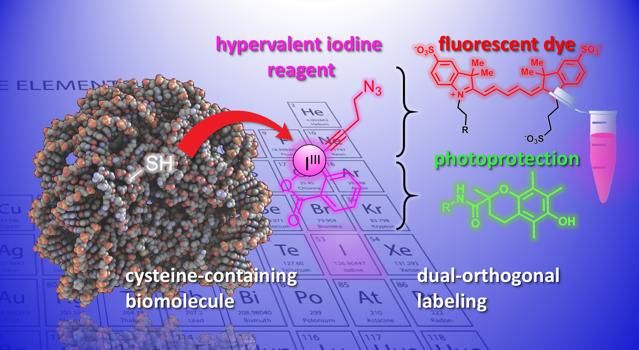
Eine Veranschaulichung der in der Studie entwickelten chemischen Reaktion.
J. Waser/B. Fierz (EPFL)
Proteine sind Makromoleküle, die aus einem Satz von zwanzig chemisch unterschiedlichen Aminosäuren aufgebaut sind. Ein wichtiger Ansatz zur Modifikation von Proteinen ist die Reaktion mit dem Schwefelatom in der Aminosäure Cystein. Die derzeitigen Methoden sind jedoch immer noch problematisch in Bezug auf Effizienz, Selektivität und Stabilität des Endprodukts (das "Addukt").
Nun haben die Labore von Jérôme Waser und Beat Fierz am Institut für Chemische Wissenschaften und Technik der EPFL eine neue Methode zur Modifikation von Cysteinen an Peptiden und Proteinen entwickelt. Das Verfahren verwendet eine Gruppe von hochreaktiven organischen Molekülen, die Ethynylbenziodoxolone (EBXs). EBXs sind hochreaktiv, da sie ein Jodatom enthalten, das an drei Substituentengruppen gebunden ist. Diese nicht-natürliche Situation führt zu einer hohen Reaktivität in diesen sogenannten "hypervalenten Jod"-Reagenzien.
Erstmals gelang es den Forschern, ein einfaches Biomolekül-EBX-Addukt zu erzeugen, während ihre reaktive Jodgruppe im Endmolekül erhalten blieb. Die Reaktion kann leicht von einem Nicht-Experten unter normalen physiologischen Bedingungen durchgeführt werden.
Das Endprodukt sind proteinhypervalente Jodreagenzchimären, die als duale Bindungspunkte für zwei neue chemische Gruppen fungieren können und neue Möglichkeiten für die Erforschung biologischer Prozesse eröffnen.
"Eine neue Funktionalität kann über die Click-Chemie eingeführt werden, eine in der chemischen Biologie etablierte Reaktion", sagt Waser. "Mit Hilfe eines Palladiumkatalysators kann eine weitere selektive Modifikation am reaktiven Jodatom erreicht werden - was wir eine "biorthogonale" Funktionalität nennen würden, da es in der Natur nicht existiert." Die Einführung solcher exotischen reaktiven Gruppen in Biomoleküle ist derzeit eines der wichtigsten Instrumente der chemischen Biologie, da sie das Studium biologischer Prozesse ohne Beeinträchtigung ermöglicht.
Die Wissenschaftler zeigten das Potenzial der Methode, indem sie verschiedene chemische Gruppen in Biomoleküle einführten. So haben die Wissenschaftler beispielsweise mit dem Doppelgriff einen Fluoreszenzfarbstoff und eine Lichtschutzgruppe gleichzeitig in ein Neuropeptid eingebracht. Die Kombination verbessert die Photostabilität des Farbstoffs und ermöglicht eine hochauflösende Einzelmolekülabbildung von molekularen Wechselwirkungen.
Neben Peptiden modifizierten sie auch kleine Proteine und sogar große Protein-DNA-Komplexe, so genannte Nukleosomen. Da Nukleosomen das Genom organisieren, kann die Markierung mit Fluoreszenzfarbstoffen helfen, sie zu verfolgen und zu entschlüsseln, wie die Natur die Genexpression reguliert.
"Was wir hier entwickelt haben, ist eine neue Methode zur Modifikation von Proteinen, die auf grundlegenden Studien zur chemischen Reaktivität basiert", sagt Fierz. "Wir haben es bereits zur Modifikation von Histonen verwendet und Fluoreszenzexperimente an lebenden Zellen durchgeführt. Mit diesen Beispielen haben wir die Grundlage für ein besseres Verständnis biologischer Prozesse geschaffen."
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.



















































