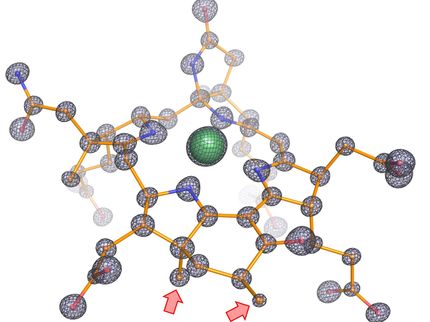
Einblick ins geschlossene Enzym
Forscher ermitteln Strukturmodell des Enzyms Adenylat-Kinase in geschlossenem Zustand
Für den Energiehaushalt der Zelle spielt das Enzym Adenylat-Kinase eine zentrale Rolle: Es beschleunigt den biochemischen Prozess, über den Energie für die Zelle gespeichert oder freigesetzt wird. Das Enzym wechselt beständig zwischen einer offenen und einer geschlossenen Form, es öffnet und schließt sich. In der geschlossenen Form ist die Adenylat-Kinase biochemisch besonders aktiv und kann „angedockte“ Moleküle, die es wie eine Muschelschale umschlossen hat – sogenannte Liganden –, in ihrer chemischen Reaktion beschleunigen. Forschern der Universität Konstanz und der schwedischen Umeå University gelang es nun, ein strukturelles Abbild des atomaren Aufbaus von dem Enzym in geschlossener Form und mit eingebettetem Liganden zu gewinnen. Mittels Kernspinresonanz-Spektroskopie und Röntgenstrukturanalyse wurden strukturelle Informationen über den geschlossenen Zustand des Enzyms erhoben – also genau jenem Moment, in dem es biochemisch besonders aktiv ist. Ein besonderer Kniff war nötig, um die Strukturanalyse im geschlossenen Zustand überhaupt erst möglich zu machen. Die Forschungsergebnisse, die wichtige Hinweise auf die biochemischen Mechanismen des Energiehaushalts der Zelle liefern, wurden im Wissenschaftsmagazin Proceedings of the National Academy of Sciences (PNAS) veröffentlicht.
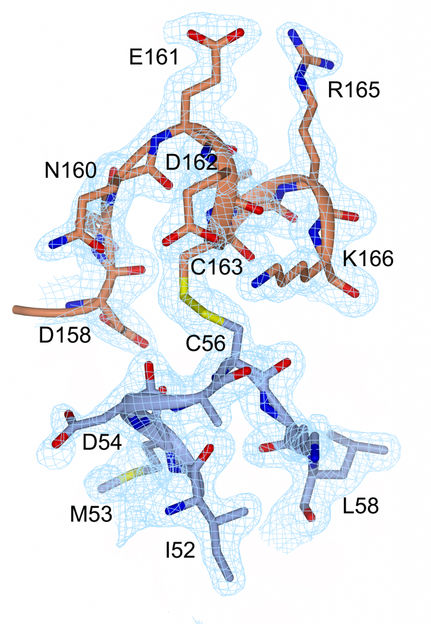
Darstellung der Elektronendichte an der ausgebildeten Disulfidbrücke (gelb, zwischen C56 und C163) und in deren Nachbarschaft.
Universität Konstanz
Wie eine Muschel öffnet und schließt sich das Enzym Adenylat-Kinase: Es öffnet sich, um einen Liganden zu empfangen, schließt sich, um ihn biochemisch zu „verarbeiten“, und öffnet sich schließlich erneut, um ihn wieder freizulassen und den nächsten Liganden zu erwarten. 340 Mal pro Sekunde geschieht dieser Vorgang – viel zu schnell, um gezielt die einzelnen Momente dieses Ablaufs per Strukturanalyse festzuhalten. Für Strukturbiologen ist es besonders interessant, Informationen über den geschlossenen Zustand des Enzyms zu gewinnen, wenn dessen biochemische Aktivität am höchsten ist. Prof. Dr. Michael Kovermann, Juniorprofessor für Magnetische Resonanzspektroskopie an der Universität Konstanz, fand einen Weg, genau dies möglich zu machen. Er nutzt eine Disulfid-Brücke als „chemischen Bindfaden“, um das Enzym in seine geschlossene Form zu zwingen und in diesem Zustand zu fixieren. Das Enzym verharrt in genau dieser Position und kann nun per Kernspinresonanz-Spektroskopie und Röntgenstrukturanalyse analysiert werden. Auf diese Weise konnten erstmals strukturelle Aufnahmen von genau jenem Moment gemacht werden, in dem das Enzym einen Liganden biochemisch umsetzt.
Zwei Jahre zuvor war es Michael Kovermann bereits gelungen, Strukturaufnahmen des Zeitpunkts zu machen, wenn das Enzym noch offen ist, aber bereits einen Liganden enthält. „Das Schöne daran ist, dass wir an diesem Enzym nun beide Grenzzustände spektroskopieren und die Strukturdaten öffentlich zugänglich machen konnten“, schildert Kovermann.
Michael Kovermanns Kniff, das Enzym in seiner geschlossenen Form zu fixieren, kann nun für weitere Untersuchungen eingesetzt werden. Über das Anbringen und Entfernen der Disulfid-Brücke lässt sich der Zustand des Enzyms steuern. Kovermanns Analysen zeigen bereits, dass die Reaktionsaffinität des Enzyms – die chemische Anziehungskraft zwischen dem Enzym und seinem Liganden – in geschlossener Form um ein vielfaches steigt, allerdings zugleich der produktive Umsatz im selben Verhältnis sinkt. Mit anderen Worten: Die chemische Aktivität zwischen Ligand und Enzym ist in geschlossener Form besonders hoch, aber der Umsatz sinkt, weil der Ligand nicht aus der geschlossenen „Muschelschale“ herauskommt und somit weniger Liganden das Enzym passieren.
Darüber hinaus konnte Kovermann nachweisen, dass die strukturelle Dynamik der Adenylat-Kinase stark von der Interaktion zwischen Enzym und Ligand abhängig ist – also von der Frage, ob ein Ligand anwesend oder abwesend ist. Hierfür verglich er den geschlossenen Zustand des Enzyms in beiden Varianten, mit und ohne eingeschlossenem Liganden. Ist der Ligand abwesend, so bleibt die Dynamik des geschlossenen Enzyms unverändert gegenüber seiner offenen Form. Erst bei Anwesenheit eines Liganden zeigen sich deutliche Veränderungen. „Das ist kontraintuitiv, das würde man so nicht erwarten“, schildert Michael Kovermann: „Diesen überraschenden Befund konnte nur die Kernspinresonanz-Spektroskopie zeigen.“
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!