Angriffswerkzeug der Bakterien hochaufgelöst in 3D
Max-Planck-Wissenschaftler entschlüsseln Struktur bakterieller Injektionsnadeln erstmals im atomaren Detail
Pest, Bakterienruhr und Cholera haben eines gemeinsam: Sie werden von Bakterien ausgelöst, die ihren Wirt mit einem ausgeklügelten Injektionsapparat infizieren. Über nadelartige Strukturen spritzen sie molekulare Wirkstoffe in ihre Wirtszellen und überlisten damit deren Immunabwehr. Forscher vom Göttinger Max-Planck-Institut für biophysikalische Chemie haben in Zusammenarbeit mit Kollegen am Berliner MPI für Infektionsbiologie und der University of Washington in Seattle (USA) jetzt die Struktur einer solchen Nadel im atomaren Detail aufgeklärt. Ihre Erkenntnisse könnten dazu beitragen, Medikamente maßzuschneidern und Strategien zu entwickeln, die den Infektionsprozess gezielt verhindern.
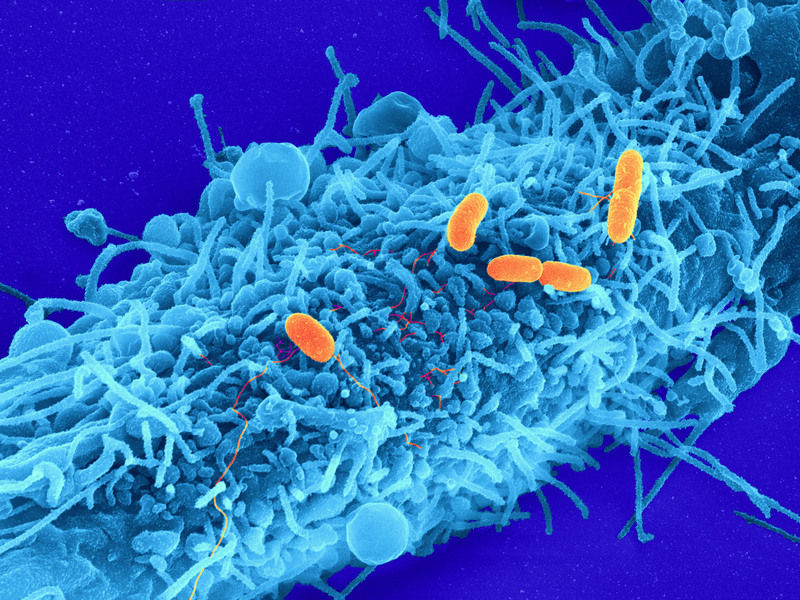
Bakterielle Infektion von Wirtszellen: Begeißelte Erreger des Typs Salmonella typhimurium (orange) nehmen Kontakt mit einer menschlichen Wirtszelle (blau) auf.
© MPI f. biophysikalische Chemie, Christian Goosmann, Diane Schad, Rashmi Gupta und Michael Kolbe
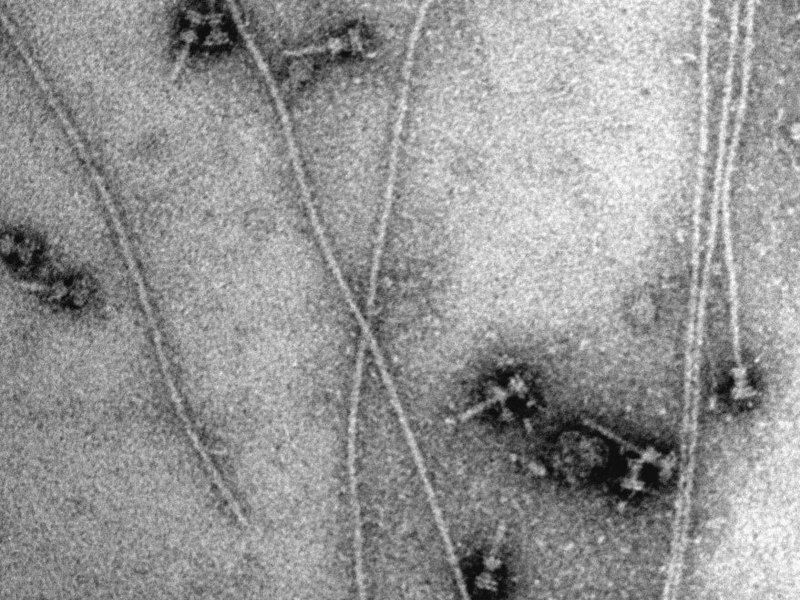
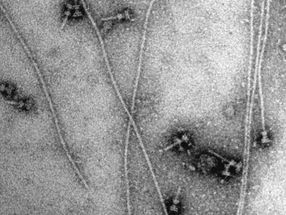
Aus Shigella flexneri isolierte Spritzen. Die Zugabe von Nadelprotein führt zu einer spontanen Verlängerung einiger Nadeln. Die Länge des Balkens entspricht 100 Nanometer (1 Nanometer entspricht einem Millionstel Millimeter).
© MPI f. biophyskalische Chemie, Christian Goosmann, Michael Kolbe
Es ist ein tückisches Werkzeug, das die Erreger von Pest oder Cholera so gefährlich macht. In Form hunderter winziger hohler Nadeln ragt es aus der Bakterienmembran heraus. Diese Miniatur-Spritzen bilden zusammen mit der in die Membran eingebetteten Basis das sogenannte Typ III-Sekretionssystem – einen Injektionsapparat, mit dem die Erreger molekulare Wirkstoffe in das Innere ihrer Wirtszellen einschleusen. Dort manipulieren die Substanzen wichtige Stoffwechselvorgänge und setzen die Immunabwehr der infizierten Zellen außer Gefecht – mit fatalen Folgen. Der Erreger kann sich nun ungehindert im Organismus ausbreiten. Einmal infiziert, helfen bislang traditionelle Antibiotika. Einzelnen Bakterienstämmen allerdings gelingt es immer wieder, Resistenzen zu bilden. Spezifischere Medikamente zu entwickeln ist daher ein wichtiges Ziel vieler Forschungsgruppen weltweit.
Die genaue Struktur der 60 bis 80 Nanometer (Millionstel Millimeter) langen und rund acht Nanometer breiten Nadeln blieb Forschern bislang verborgen. Klassische Methoden wie die Röntgenkristallographie oder die Elektronenmikroskopie versagten bisher oder ergaben falsche Modellstrukturen. Nicht kristallisier- und unlösbar widersetzte sich die Nadel allen Versuchen, ihren atomaren Aufbau zu entschlüsseln. Ein Team von Physikern, Biologen und Chemikern um Adam Lange und Stefan Becker am MPI für biophysikalische Chemie in Göttingen wählte daher einen völlig neuen Ansatz. In Kooperation mit David Baker an der University of Washington und Michael Kolbe am MPI für Infektionsbiologie stellten die Wissenschaftler die Nadel im Labor her und kombinierten Festkörper-NMR-Spektroskopie, Elektronenmikroskopie und Computermodellierung – mit Erfolg: Atom für Atom haben die Forscher die Struktur der Nadel aufgeklärt und ihren molekularen Aufbau erstmals im Ångström-Bereich sichtbar gemacht – das ist eine Auflösung von weniger als einem Zehntel eines millionstel Millimeters.
Fortschritte auf mehreren Gebieten waren dafür nötig. „Methodisch sind wir einen großen Schritt vorangekommen, beim Herstellen der Proben ebenso wie bei der Festkörper-NMR-Spektroskopie“, sagt Lange. „Nicht zuletzt konnten wir in der Abteilung NMR-basierte Strukturbiologie von Christian Griesinger an einem der derzeit leistungsfähigsten Festkörper-NMR-Spektrometer weltweit messen.“ Das Magnetfeld dieses 850 Megahertz-Spektrometers ist mit 20 Tesla rund 400 000-mal so stark wie das der Erde. „Der Bauplan der Nadeln barg für uns große Überraschungen“, erzählt Lange. Die Nadeln von Erregern so unterschiedlicher Krankheiten wie Salmonellenvergiftung, Bakterienruhr oder Pest zeigen auffällige Gemeinsamkeiten – wie erwartet. Doch anders als bisher vermutet ist es der innere Teil der Nadeln, der bei den unterschiedlichen Erregern auffallend ähnlich aufgebaut ist. Die Oberfläche der Nadel dagegen ist erstaunlich variabel. „Diese Wandelbarkeit könnte eine Strategie der Bakterien sein, um der Immunabwehr des Wirts zu entkommen“, meint Kolbe. Veränderungen auf der Nadeloberfläche könnten es dem Immunsystem des Wirts erschweren, den Erreger wiederzuerkennen.
Der Injektionsapparat der Bakterien beschäftigt die Wissenschaftler Lange, Kolbe, Becker und ihre Max-Planck-Kollegen Christian Griesinger und Arturo Zychlinsky schon seit mehreren Jahren. Bereits 2010 hatten sie gemeinsam mit der Bundesanstalt für Materialforschung und -prüfung herausgefunden, wie Bakterien ihre Miniatur-Spritzen zusammenbauen. Dass die Forscher nun auch ihren Bauplan im atomaren Detail kennen, ermöglicht nicht nur wichtige neue Einblicke, wie diese Erreger ihre Wirtszellen überlisten. Es eröffnet zugleich die Perspektive, den Aufbau der Spritze und das Einschleusen der bakteriellen Wirkstoffe in die Wirtszelle mit einem maßgeschneiderten Molekül zu blockieren. Solche Substanzen, Anti-Infektiva genannt, könnten spezifischer und zu einem viel früheren Zeitpunkt der Infektion wirken als traditionelle Antibiotika. „Unser neues Verfahren erlaubt es uns endlich, die Nadeln im Labor in größerer Menge herzustellen. Unser Ziel ist es nun, Hochdurchsatzverfahren zu entwickeln, um nach neuen Wirkstoffen zu suchen, die die Nadelbildung verhindern“, erklärt Stefan Becker.