Rückwärtsgang im Nanotunnel
Neues Verfahren erleichtert Analyse von Nukleinsäuren
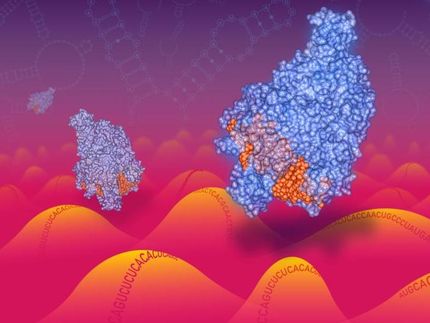
Wie bei Proteinen beeinflusst auch bei Nukleinsäuren - also den Erbmolekülen DNA und RNA - die dreidimensionale Struktur deren Eigenschaften. Die Verwendung von Nanoporen zur Strukturbestimmung ist eine noch junge, aber vielversprechende Technik. Allerdings verhinderten Interaktionen zwischen Protein-Pore und Molekül bisher, das Verhalten selbst einfach strukturierter Moleküle während der Passage durch die Pore - der sogenannten Translokation - quantitativ zu verstehen. Dies ist aber notwendig, um die Technik langfristig für die Strukturbestimmung einsetzen zu können. Einem Forscherteam um LMU-Physiker Professor Ulrich Gerland und Professor Friedrich Simmel, TU München, gelang es nun im Rahmen des Exzellenzclusters „Nanosystems Initiative Munich“ (NIM), ein neues Verfahren zu entwickeln, das die Nukleinsäuren im Rückwärtsgang analysiert und so störende Einflüsse minimiert. Dies erlaubte den Wissenschaftlern, ein theoretisches Modell zu erstellen, das die Translokationsdynamik verschiedener Molekülsequenzen vorhersagen kann.
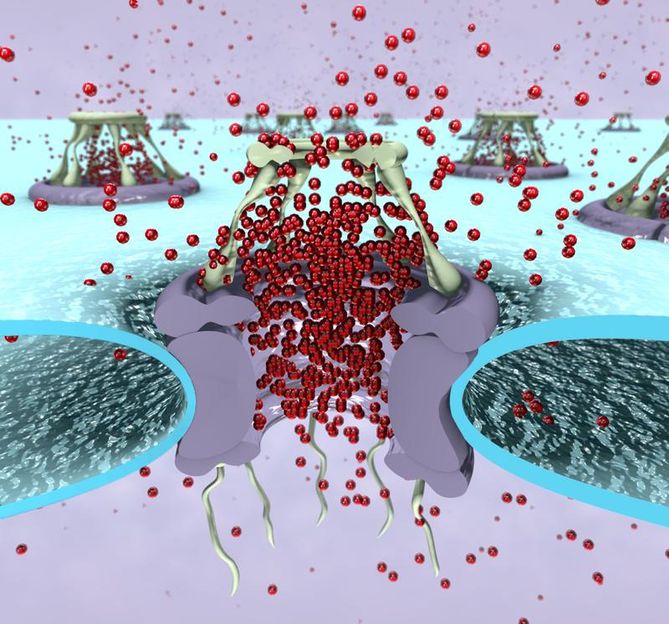
Die Nukleinsäuren RNA und DNA sind sogenannte Polynukleotide, die aus einer kettenförmigen Abfolge bestimmter Bausteine bestehen. Sofern sie als Einzelstrang vorliegen, können sie zudem sogenannte Sekundärstrukturen ausbilden: Bestimmte Abschnitte des Strangs gehen dann eine Verbindung ein, während das dazwischen liegende Stück eine Schleife bildet. Ist die Schleife kurz, wird die Sekundärstruktur als Haarnadelstruktur bezeichnet. Wie bei Proteinen beeinflusst die Sekundärstruktur auch bei Nukleinsäuren die Moleküleigenschaften, ihre Aufklärung ist daher von großem Interesse. „Um die Sekundärstruktur von RNA und DNA zu untersuchen, werden zunehmend Nanoporen eingesetzt: Man nutzt dabei aus, dass die Moleküle sich bei der Passage durch die engen Poren entfalten müssen und gewinnt Einblick in die Moleküleigenschaften, ohne dass man fluoreszierende Markierungen anbringen muss“, erklärt Gerland, „diese Technik ist noch recht jung und ihre Möglichkeiten sind bei Weitem noch nicht ausgeschöpft“. Nun gelang es den Wissenschaftlern, ein neues experimentelles Verfahren zu entwickeln, das es ermöglicht, die Passage einfach strukturierter Polynukleotide durch Nanoporen quantitativ zu verstehen und in einem theoretischen Modell darzustellen. Bisher war dies nicht möglich, weil Komplikationen wie etwa Interaktionen zwischen der Protein-Nanopore und dem Polynukleotid die Messungen signifikant beeinflussten und schwer vorherzusagen waren. Diese Komplikationen konnten nun durch ein verändertes experimentelles Design minimiert werden. Der entscheidende Trick dabei ist, die Analyse im Rückwärtsgang – das heißt gegenläufig zur Einfädelrichtung - zu machen: Das Polynukleotid wird durch das Anlegen einer elektrischen Spannung zunächst durch die trichterartige Öffnung auf der einen Seite der Pore gefädelt, wobei es sich entfaltet und nach der Passage - der sogenannten Translokation - seine Sekundärstruktur wieder einnimmt. Ein „Anker“ am Ende des Strangs verhindert das vollständige Durchrutschen durch die Pore. Anschließend wird der Strang wieder auf die Startseite zurückgeholt, wobei er sich nun an der engen Seite der Pore entfalten muss - und erst jetzt erfolgt die Analyse. „Im Gegensatz zur Vorwärts-Translokation scheinen dabei keine signifikanten Interaktionen stattzufinden“, sagt Simmel. Mithilfe der Ergebnisse entwickelten die Wissenschaftler ein theoretisches Modell, das die Translokationsdynamik verschiedener Haarnadelstrukturen mithilfe thermodynamisch berechneter sogenannter „freier Energielandschaften“ vorhersagen kann. „Dies kann eine Grundlage sein für die zukünftige Strukturaufklärung auch von komplizierteren Polynukleotid-Sekundärstrukturen“, blickt Gerland in die Zukunft.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.