Hepatitis: 3D-Strukturbestimmung des "Tores" zur Leber
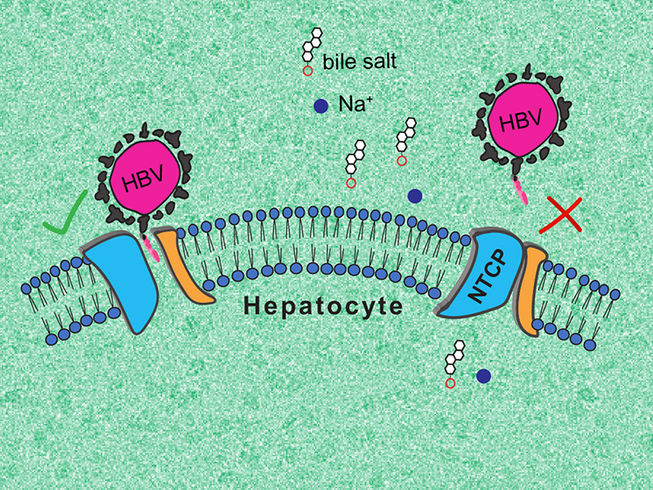
Obwohl NTCP ein wichtiges Tor zur Leber ist, wurde es bisher nicht gut beschrieben. Das Na+-Taurocholat-cotransportierende Polypeptid (NTCP) ist ein Protein, das ausschließlich in der Membran von Leberzellen vorkommt und das Recycling von Gallensäuremolekülen ermöglicht. Es ist auch der zelluläre Rezeptor für menschliche Hepatitis-B- und -D-Viren (HBV/HDV). Ein besseres Verständnis von NTCP könnte die Entwicklung von Behandlungen ermöglichen, die speziell auf die Leber zugeschnitten sind und die Infektion mit HBV und HDV bekämpfen.
Veranschaulichung der beiden 3D-Konformationen, die die NTCPs annehmen. Links: "offene" Konformation, an die HBV und HDV binden können. Rechts: "geschlossene" Konformation, die die Erkennung durch die Viren verhindert.
© Kapil Goutam/Nicolas Reyes/CNRS
NTCP ist ein schwer zu untersuchendes Protein. Es wiegt nur 38 Kilodalton (kDa), während die Kryo-Elektronenmikroskopie, die Technologie zur Untersuchung dieser Art von Molekülen, nur für Moleküle mit einem Gewicht von mehr als 50 kDa funktioniert. Die Herausforderung bestand also darin, es zu "vergrößern" und zu stabilisieren.
Zu diesem Zweck haben Teams aus französischen und belgischen Labors eine Reihe von Antikörperfragmenten entwickelt und getestet, die auf NTCP abzielen. Die 3D-Strukturen der resultierenden Komplexe wurden mit Hilfe der Kryo-Elektronenmikroskopie bestimmt, und verschiedene Antikörperfragmente stabilisierten und enthüllten mehrere Formen von NTCP.
Das Forscherteam konnte zwei wesentliche NTCP-Konformationen beschreiben: eine, in der das Protein eine große Membranpore für Gallensalze öffnet, an die HBV und HDV binden können, und eine zweite, "geschlossene" Konformation, die die Erkennung durch die Viren verhindert.
Die erste, "offene" Konformation ist sehr überraschend, da kein anderer bekannter molekularer Transporter eine so "weit offene" Pore bildet. Die zweite Konformation wiederum könnte helfen, antivirale Moleküle zu finden, die eine Infektion mit HBV und HDV verhindern. Das Forscherteam beabsichtigt, seine Arbeit fortzusetzen, um die Funktionsweise von NTCP vollständig zu entschlüsseln.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.
Meistgelesene News
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.



















































