Neue Methode zur Optimierung der plasmonengestützten Spektroskopie
Entwirren der optischen Parameter
Für die Erforschung des Nanobereichs weit über die optische Auflösungsgrenze hinaus ist die spitzenverstärkte Raman-Spektroskopie (TERS) weithin als eine wesentliche, aber noch in der Entwicklung befindliche Technik anerkannt. Mit dieser markerfreien spektroskopischen Methode gewinnen Wissenschaftler Einblicke in die strukturelle und chemische Zusammensetzung von Oberflächen mit einer Auflösung im Nanobereich, die mit anderen Methoden nicht zugänglich sind. Beispiele, bei denen solche Spektroskopien mit nanoskaliger Auflösung entscheidend sind, sind Strukturuntersuchungen, von neuartigen Materialien (z.B. Diamantschichten, 2D-Materialien usw.), von Proteinaggregaten, die als Auslöser von Krankheiten wie Diabetes Typ II oder Alzheimer oder sogar von katalytischen Reaktionen am Arbeitsplatz diskutiert werden. Das mangelnde Verständnis der Wissenschaftler für die entscheidenden Parameter der eigentlichen Sonde schränkt jedoch das Potenzial von TERS als benutzerfreundliches Analysewerkzeug noch immer ein. Bis jetzt ist es den Wissenschaftlern nicht gelungen, die grundlegendsten experimentellen Parameter wie die Oberflächenplasmonenresonanz der Spitze, die Erwärmung aufgrund des Temperaturanstiegs im Nahfeld und die Verbindung zur räumlichen Auflösung zu entschlüsseln.
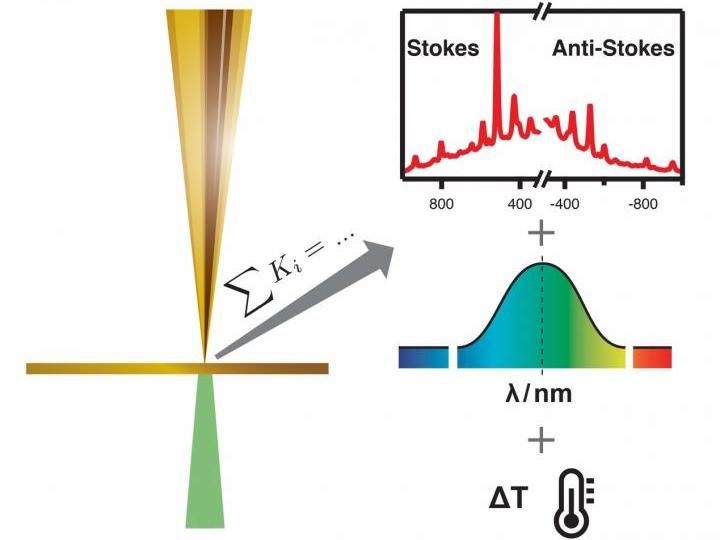
Auf der linken Seite ist eine schematische Darstellung eines TERS-Experiments (TERS = Tip-enhanced Raman Scattering) zu sehen. Eine metallisierte AFM-Sonde wird in die Nähe einer Probenoberfläche gebracht, ein Laser wird auf die Spitze-Proben-Grenzfläche fokussiert. Ein solcher Aufbau ermöglicht es, Schwingungsspektren (Raman-Spektren) einer extrem kleinen Region zu erhalten, die so klein ist wie ein einzelnes Molekül oder sogar eine einzelne Bindung. Ein Beispiel für sogenannte Stokes- und Anti-Stokes-Regionen von Spektren, die durch ein solches Experiment erhalten werden, ist in der oberen rechten Spalte dargestellt. Eine gründliche Bewertung der Spektren, wie sie von den Autoren gezeigt wird, erlaubt es, die struktursensitiven Raman-Spektren und synchron die spezifischen Plasmonenresonanzeigenschaften der jeweiligen Spitze und der jeweiligen Temperatur zu erhalten. Auf diese Weise werden spitzeninduzierte Veränderungen während einer Messung aufgedeckt, was das Verständnis des Experiments deutlich verbessert.
by Marie Richard-Lacroix and Volker Deckert
In einer neuen Veröffentlichung in "Light: Light: Science & Application" stellt ein Forscherteam aus Jena nun die erste zugängliche Methode vor, mit der bisher unerreichte Einblicke in die plasmonische Aktivität eines einzelnen Nanopartikels während eines typischen TERS-Experiments gewonnen werden können. Prof. Volker Deckert vom Leibniz-Institut für Photonische Technologie, Jena, und Dr. Marie Richard-Lacroix von der Friedrich-Schiller-Universität Jena schlagen eine einfache und rein experimentelle Methode vor, um die Plasmonenresonanz und die Nahfeldtemperatur zu bestimmen, die ausschließlich von den Molekülen erfahren werden, die direkt zum TERS-Signal beitragen. Unter Verwendung von Standard-TERS-Experimentiergeräten bewerten die Wissenschaftler die detaillierte optische Nahfeldreaktion sowohl auf molekularer Ebene als auch als Funktion der Zeit, indem sie gleichzeitig die Stokes- und Anti-Stokes-Spektralintensitäten sondieren. Dies ermöglicht ihnen, die optischen Eigenschaften jeder einzelnen TERS-Spitze während der Messung zu charakterisieren.
"Die vorgeschlagene Methode könnte ein wichtiger Schritt sein, um die Nutzbarkeit von TERS im täglichen Betrieb zu verbessern", erklärt Prof. Deckert. "Die tatsächlichen Bedingungen, denen die Moleküle von einem Experiment zum nächsten unterworfen werden, können nun direkt, in Echtzeit und im Probenmaßstab untersucht und optimiert werden", erklärt Prof. Deckert. Dies ist besonders relevant, wenn es darum geht, biologische Proben wie z.B. Proteine, die keine hohen Temperaturen vertragen, zu untersuchen.
"Nach unserem besten Wissen eröffnet keine andere zugängliche Methodik den Zugang zu einer solchen Fülle von Informationen über die plasmonische Aktivität während eines typischen TERS-Experiments", sagt Dr. Richard-Lacroix.
"Wir glauben, dass diese Methodik dazu beitragen wird, die Genauigkeit der theoretischen Modelle zu verbessern und jede experimentelle plasmonische Untersuchung und die Anwendung von TERS im Bereich der Thermometrie im Nanobereich zu erleichtern", sehen die Wissenschaftler voraus.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

























































