Den Proteinzustand erfühlen
Molekulare Sonde zeigt in lebenden Zellen Bereiche mit fehlgefalteten Proteinen an
In gestressten Zellen sammeln sich häufig fehlgefaltete, inaktive Proteine an. Australische Wissenschaftler haben nun eine molekulare Sonde entwickelt, die den Faltungszustand des Proteoms, der Gesamtheit der Proteine einer Zelle, anhand der Polarität erfasst. In ihrer Studie in der Zeitschrift Angewandte Chemie erläutern sie, wie die Sonde durch ein Fluoreszenzsignal entfaltete Proteine anzeigt und dabei wie ein Chamäleon die Farbe wechselt.
© Wiley-VCH
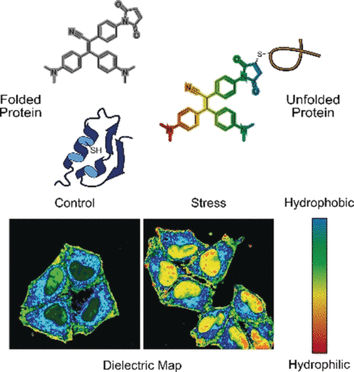
Stress bringt Zellen aus dem Gleichgewicht. Ihre Proteinsynthese und die Maschinerie zur korrekten Faltung von Proteinen werden gestört. Fehlgefaltete Proteine kommen nicht an ihren Wirkungsort und werden wieder abgebaut. Dadurch sammeln sich im Zytoplasma inaktive Proteine und Abbauprodukte an, die sich auch bei neurodegenerativen Erkrankungen und Krebs bemerkbar machen. Angenommen wird, dass die Polarität bei der Aggregation eine Rolle spielt. Yuning Hong und ihre Grupe von der La Trobe University Melbourne in Australien haben nun zusammen mit Kollegen eine bimodale fluorogene Sonde entwickelt, die den Zustand der Proteinaggregation anhand der Polarität anzeigt.
Ein Modus der Sonde ist das Erspüren fehlgefalteter Proteine. Korrekt gefaltete Proteine werden häufig durch interne Brücken aus der Aminosäure Cystein stabilisiert. Diese Brücken liegen zumeist tief im Inneren des Proteins. Bei fehlgefalteten und entfalteten Proteinen befinden sich die Cysteine außen. Wenn die Sonde an einem äußeren Cystein bindet, schaltet sich das Fluoreszenzsignal ein, schreiben die Autoren.
Der andere Modus ist die Erfassung der Polarität. Eine polare Umgebung bedeutet eine unausgewogene elektronische Verteilung, die als Dielektrizitätskonstante gemessen werden kann. Um diesen Parameter zu messen, fügten die Forscher der fluorogenen Sonde eine chemische „Push–Pull“-Gruppe hinzu. Durch die Erspürung des elektronischen „Drucks“ oder „Zugs“ verschob sich das Fluoreszenzsignal in polaren Lösungen mit hoher Dielektrizitätskonstante. Wie ein Chamäleon änderte die Sonde ihre Farbe.
Die Autoren testeten die NTPAN-MI-Sonde an einer menschlichen Zelllinie, die durch Wirkstoffe in ihrer Proteinsynthese beeinträchtigt war. Unbehandelte Zellen zeigen normale, gleichmäßige Fluoreszenz. Zellen, die mit Toxinen oder Viren behandelt wurden, sammelten jedoch fehlgefaltete Proteine an, was sich als verstärkte Fluoreszenz bemerkbar machte. Darüber hinaus signalisierte ein farbverschobenes Fluoreszenzsignal die Polarität der Umgebung und damit den Zustand des Proteoms, der Gesamtheit der Proteine. Laut Aussage der Autoren wurde somit zum ersten Mal der Anteil der ungefalteten oder fehlgefalteten Proteine im Zellkern sichtbar gemacht. Bislang konnte man nur entfaltete Proteine im Zytoplasma erfassen.
Mit ihren beiden Sensormoden – Messung des Entfaltungszustands und der Polarität – liefert die NTPAN-MI-Sonde ein schärferes Bild über die Stressreaktion von Zellen, als es mit monomodalen Sonden oder mit anderen Methoden bislang möglich war. Die Autoren glauben, dass die neue Technik dazu beitragen könnte, besser zu verstehen, wie die Stressantwort in den Zellkompartimenten aussieht und wie diese miteinander kommunizieren.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.



















































