Aminosäuren unterscheiden: Grundlage für direkte Sequenzierung einzelner Proteine geschaffen
In Zellen verrichten Proteine als Enzyme, Transporter, Kanäle, Motoren, Stützpfeiler und Signalgeber die eigentliche Arbeit. Sie sind dreidimensional gefaltete Ketten aus unterschiedlichen Aminosäuren, deren Abfolge genetisch festgelegt ist. Nachdem es bereits gelungen ist, die Sequenz eines einzelnen DNA-Stranges zu lesen, besteht eine weitere große Herausforderung für die Bioanalytik darin, die Aminosäurresequenz einzelner Proteine direkt zu bestimmen. Ein Team aus Forschern der Universität Cergy-Pontoise/Frankreich, der Universität Freiburg und der Universität von Illinois/USA konnte nun erstmals mithilfe einer winzigen Pore von Nanometergröße einzelne Aminosäuren in kurzen Peptiden, also Bruchstücken von Proteinen, voneinander unterscheiden. Damit haben die Wissenschaftler die Grundlagen für eine direkte Sequenzierung einzelner Proteine gelegt.
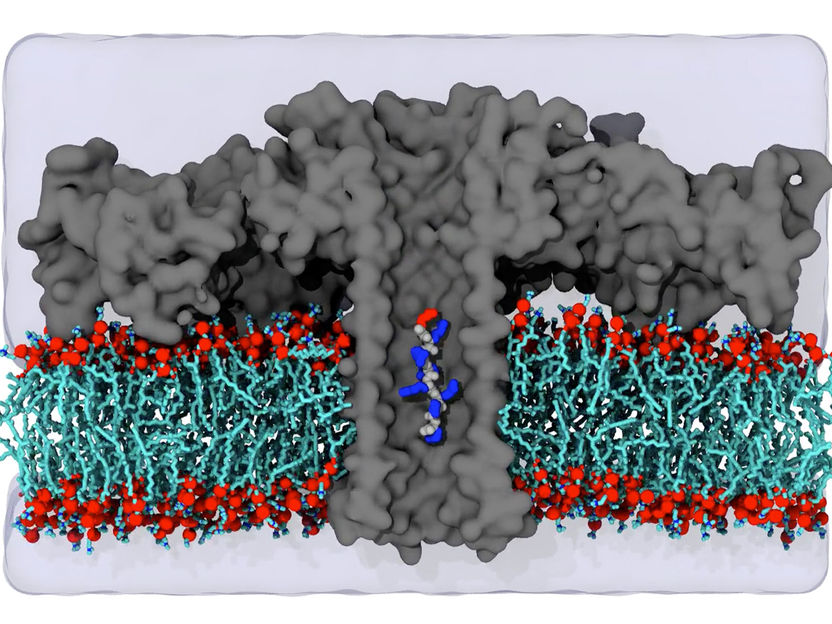
Simulation eines Aerolysinkanals.
Nature Biotechnology
Bisherige Techniken, wie die Massenspektrometrie, sind nicht empfindlich genug, um zum Beispiel die Proteinzusammensetzung einer einzelnen Zelle fehlerfrei bestimmen zu können. Deshalb wurde für die jetzt veröffentlichte Studie das porenbildende Protein Aerolysin in eine künstliche Zellmembran eingebaut und mithilfe von Elektroden ein Ionenstrom durch die Pore geschickt, erklärt der an der Studie beteiligte Prof. Dr. Jan C. Behrends vom Physiologischen Institut der Medizinischen Fakultät der Universität Freiburg. Bereits vor einigen Jahren hatten die Forscher der Universitäten in Freiburg und Cergy nachgewiesen, dass Blockaden dieses Stroms durch ein in die Pore eintretendes Molekül eine sehr empfindliche Messung seiner Größe ermöglichen. Darauf aufbauend konnte das Team nun zeigen, dass die Empfindlichkeit der so genannten Aerolysinpore so groß ist, dass Peptide, die nur in einer Position unterschiedliche Aminosäuren aufweisen, voneinander unterschieden werden können.
Mit einer besonders hochauflösenden, an der Albert-Ludwigs-Universität entwickelten, elektrophysiologischen Messmethode gelang es sogar, die Aminosäuren Leucin und Isoleucin mit mehr als 90 Prozent Zuverlässigkeit zu unterscheiden. Diese beiden Aminosäuren besitzen die gleiche Zusammensetzung, also Masse, und weisen lediglich eine unterschiedliche räumliche Anordnung der Molekülgruppen auf. Die Unterscheidung solcher so genannter Strukturisomere mit Hilfe der Aerolysin-Pore beweist einerseits, dass das Stromsignal nicht ausschließlich von der Molekülmasse abhängt, wie bislang angenommen wurde. Gleichzeitig bedeutet dies, dass die neue Technologie der Massenspektrometrie prinzipiell überlegen ist. Die Forscher in den USA zeigten in Simulationen, dass die hohe Auflösung auf einer Art molekularer Falle innerhalb der Pore basiert. Diese Falle stellt die Peptide für ungefähr eine Hundertstelsekunde ruhig, was die genaue Messung erst ermöglicht. Dadurch konnten für die jetzt veröffentlichte Studie elf der 20 am Aufbau von Proteinen beteiligten Aminosäuren mithilfe des Nanoporen-Stromsignals ohne zusätzliche chemische Veränderung zuverlässig unterschieden werden.
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
Ouldali, H., Sarthak, K., Ensslen, T., Piguet, F., Manivet, P., Pelta, J., Behrends, J.C., Aksimentiev, A., Oukhaled, A.; "Electrical recognition of the twenty proteinogenic amino acids using an aerolysin nanopore"; Nature Biotechnology; 2019
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.

















































