Dynamik einzelner Proteine
Neue Messmethode kann Bewegung von Molekülen lange und genau verfolgen
Das Zusammenspiel aus Struktur und Dynamik bestimmt die Funktion von Proteinen, den molekularen Werkzeugen der Zelle. Durch Fortschritte in der Elektronenmikroskopie können Wissenschaftler die Strukturinformationen inzwischen gut erfassen, jedoch ist es bisher schwer, die Proteindynamik für eine Analyse über lange Zeiträume hinweg zu messen. Ein Team um Prof. Dr. Thorsten Hugel vom Institut für Physikalische Chemie und dem Exzellenzcluster BIOSS Centre for Biological Signalling Studies der Universität Freiburg und Prof. Dr. Carsten Sönnichsen von der Johannes Gutenberg-Universität Mainz konnte nun mit einer neuen Methode über 24 Stunden hinweg die Dynamik einzelner funktionaler Proteine aufzeichnen. Vergleichbare Messungen waren vorher nur für wenige Sekunden möglich.

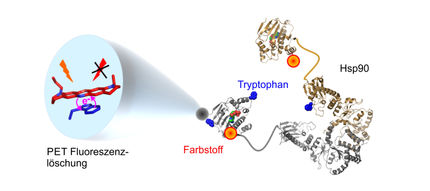
Die Abbildung zeigt ein sogennantes 'Plasmonisches Lineal‘. Dieses besteht aus zwei Goldnanopartikeln, die über ein Protein (hier Hsp90) verbunden sind. Damit kann die Dynamik des Proteins über viele Stunden mit Videorate beobachtet werden.
Universität Freiburg / Universität Mainz
Die Forscher verbinden dazu zwei Gold-Nanopartikel mit dem zu untersuchenden Protein und beobachten die abstandsabhängige Wechselwirkung der Gold-Kugeln mit Hilfe von Laserstrahlen. Die Stabilität dieses molekularen Ensembles erlaubt es, ein Video der Bewegung des Proteins über einen ganzen Tag hinweg zu erstellen. Damit erweitert es den bisher erreichbaren Messbereich von anderen Einzelmolekül-Messungen um mehrere Größenordnungen und ermöglicht neue Fragestellungen: So könnte in Zukunft getestet werden, ob einzelne Moleküle ein Gedächtnis haben oder ob sich Proteine mit einem identischen chemischen Aufbau auch über lange Zeiten identisch verhalten.
Der Biochemiker und Physiker Dr. Markus Götz aus der Gruppe um Hugel an der Albert-Ludwigs-Universität ist Experte für das Hitzeschockprotein Hsp90. Dieses kommt in menschlichen Zellen oft vor und steuert viele grundlegende Prozesse entscheidend – es ist etwa maßgeblich daran beteiligt, dass einfache Aminosäureketten zu funktionierenden Proteinen mit einer genau definierten Struktur gefaltet werden. „Wir konnten zum ersten Mal erstaunlich langsamen Bewegungen in Hsp90 beobachten, deren Bedeutung uns noch nicht vollständig klar ist“, erklärt Hugel.
Elektronik-Ingenieur Weixiang Ye aus der Mainzer Gruppe um Sönnichsen hat einen stark verbesserten Messaufbau für dieses Projekt entwickelt. Wichtig war zum Beispiel, die riesige Datenmenge während der 24-Stunden-Aufzeichnung so stark zu reduzieren, dass die Aufnahmen auf normalen Computern abspielbar sind. Die biomedizinischen Chemiker Sirin Celiksoy und Laura Tüting von der Universität Mainz führten die komplexe chemische Prozedur durch, die erforderlich ist, um ein einzelnes Protein gezielt zwischen zwei winzige Gold-Nanokugeln zu bringen und dafür zu sorgen, dass die Goldkugeln nicht zusammenkleben.
Für ihr Projekt wird Arbeitsgruppenleiter Hugel, genau wie bereits sein Kollege Sönnichsen jeweils mit einem Grant des European Research Council (ERC) gefördert. „Die ERC-Finanzierung hat es uns ermöglicht, über viele Jahre dieses Projekt zu verfolgen – obwohl es uns fast zehn Jahre lang nicht gelang, diese Messungen zu machen und zu analysieren“, sagt Sönnichsen. „Keiner von uns hätte so ein komplexes Projekt alleine geschafft. Entscheidend war, dass wir unsere jeweiligen Expertisen in Mainz und Freiburg verbunden haben.“ Aufgrund der aktuellen Ergebnisse sind sich Hugel und Sönnichsen sicher: „Wir wollen unsere Kooperation fortsetzen und vertiefen.“
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
Weixiang Ye, Markus Götz, Sirin Celiksoy, Laura Tüting, Christoph Ratzke, Janak Prasad, Julia Ricken, Seraphine V. Wegner, Rubén Ahijado-Guzmán, Thorsten Hugel und Carsten Sönnichsen; "Conformational dynamics of a single protein monitored for 24 hours at video rate"; Nano Letters; 2018
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.