Unkraut im Gehirn
Hochauflösende 3D-Struktur der Huntingtin-Aggregate erstellt
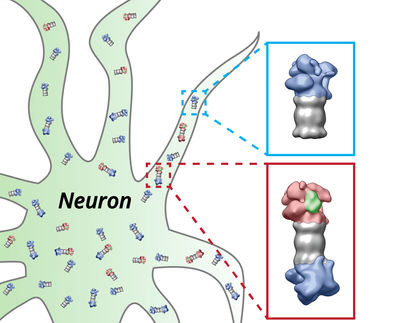
Alzheimer, Parkinson und Huntington – neurodegenerative Krankheiten haben eine Gemeinsamkeit: In den Nervenzellen der Patienten sammeln sich Proteinablagerungen an. Sind diese Aggregate erst einmal vorhanden, wuchern sie wie Unkraut. Ob und wie die Ablagerungen Nervenzellen schädigen und zu deren Absterben führen, ist noch weitgehend ungeklärt. Ein detaillierter Einblick in die dreidimensionale Struktur der Proteinaggregate soll den Forschern helfen, dieses Rätsel zu lösen. Wissenschaftler am Max-Planck-Institut für Biochemie konnten jetzt mittels Kryo-Elektronentomographie ein hochauflösendes, dreidimensionales Modell der für die Huntington-Krankheit verantwortlichen Aggregate erstellen.

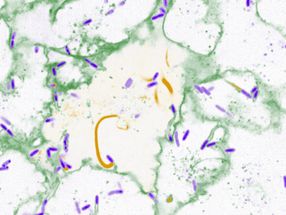
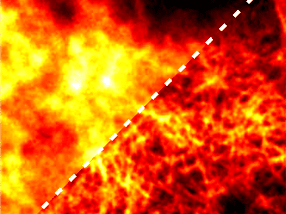
Mittels Kryoelektronentomographie wurde eine hochauflösende 3D-Struktur der Huntingtin-Aggregate erstellt. Hintergrund: Rohdaten, Vordergrund: 3D-Visualisierung
© MPI für Biochemie
Wild wucherndes Unkraut – der Alptraum eines jeden Gärtners. Beschneiden, Stutzen, Mähen. Eine gründliche Gartenpflege ist nötig. Wird diese vernachlässigt, nimmt das Unkraut Überhand und unterdrückt das Wachstum der Nutz- und Zierpflanzen. In unserem Körper läuft es auf Proteinebene ähnlich: Molekulare Maschinen, große Proteinkomplexe, die in Zellen lebenswichtige Prozesse steuern, übernehmen die Funktion eines Gärtners: Sie bringen Proteine in die richtige Form und hegen und pflegen diese.
Auf die richtige Form kommt es an
Damit Proteine ihre Funktion erfüllen können, müssen sie die korrekte dreidimensionale Struktur haben. Die Bausteine der Proteine, die Aminosäuren, sind in einer langen Kette aneinandergereiht und werden in eine komplexe Faltung gebracht. Ist die entstandene Anordnung fehlerhaft, werden die defekten Proteine in einem streng regulierten Prozess abgebaut. Geschieht dies nicht, können sie verklumpen und Ablagerungen bilden. Die unlöslichen Proteinaggregate wirken toxisch auf Zellen. Das Gehirn von Patienten mit neurodegenerative Krankheiten wie Alzheimer, Parkinson oder Huntington weist häufig solche Aggregate auf.
Ob und wie genau diese Aggregate Nervenzellen schädigen, ist bisher ungeklärt. Dieser Frage gehen Experten des ToPAG (Toxic Protein AGgregation in neurodegeneration) Konsortiums nach. Ein Team von Wissenschaftlern der Abteilungen von Wolfgang Baumeister, Ulrich Hartl und Rüdiger Klein konnte eine hochauflösende 3D-Struktur der Proteinaggregate, die mit der Huntington-Krankheit assoziiert sind, innerhalb ihrer intakten zellulären Umgebung entschlüsseln.
Eiskalt unter die Lupe genommen
Möglich war dies durch eine neuartige Technik in der Strukturforschung, der Kryo-Elektronentomographie. Dabei werden Zellen blitzartig eingefroren und am Elektronenmikroskop zweidimensionale Aufnahmen aus verschiedenen Winkeln erstellt. Die Forscher können die entstandenen Bilder dann – wie Teile eines 3D-Puzzles – am Computer zu einem hochaufgelösten Modell zusammensetzen. „Mit dieser Methode können wir eine Momentaufnahme der Struktur von Proteinen in intakten Zellen erstellen und analysieren, mit welchen anderen Zellbestandteilen diese Proteine interagieren“, erklärt Rubén Fernández-Busnadiego, Koordinator der Studie, die Besonderheiten dieser Technik.
Als die Wissenschaftler Nervenzellen mit Proteinablagerungen unter die Lupe nahmen, fanden sie Einschlusskörper, bestehend aus verklebten, faserartigen Bündeln des Huntingtin-Proteins (Fibrillen). Bei Patienten, die von der Huntington-Krankheit betroffen sind, ist dieses Protein aufgrund einer Veränderung eines einzelnen Gens fehlerhaft: Die DNA, die Bauanleitung der Proteine, enthält aneinandergereiht mehrfache Kopien einer bestimmten Sequenz. Im fertigen Protein wird deswegen vermehrt der Proteinbaustein Glutamin an das Ende angeheftet. Die fehlerhaften Huntingtin-Proteine sind dadurch besonders klebrig und verklumpen leicht zu unlöslichen Knäueln.
„Mit der Zeit lagern sich immer mehr solcher Proteinaggregate ab“, erklärt Felix Bäuerlein, Erstautor der Studie. Um beim Vergleich zur Gartenarbeit zu bleiben: In Gehirnzellen wuchert es wie Unkraut. Wo es einmal wächst und nicht säuberlich entfernt wird, vermehrt sich das Unkraut. Und wie dieses in das Pflanzenbeet einwächst und Nutz- und Zierpflanzen verdrängt, wirken die verklumpten Proteine auf benachbarte Zellbestandteile und Proteine. „Breiten sich die Ablagerungen aus, verformen sie an den Kontaktstellen die Membranen umliegender Zellbestandteile. Teilweise kann das zum Zerreißen dieser Hülle führen“, so Bäuerlein. Eine der betroffenen Zellstrukturen ist beispielsweise das Endoplasmatische Retikulum. Womöglich wird so die Funktion gesunder Organellen und Proteine beeinträchtigt. „Wir gehen davon aus, dass auf diese Weise nach und nach die Infrastruktur der Zelle zerstört wird“, schlussfolgert Fernández-Busnadiego.
Bisherige Therapien behandeln nur die Symptome neurodegenerativer Erkrankungen, eine Heilung der Patienten ist noch nicht möglich. „Mithilfe der Struktur der Proteinaggregate wollen wir die toxische Wirkung auf Nervenzellen besser verstehen. Auf dieser Grundlage erhoffen wir uns, in Zukunft neuartige Behandlungsansätze zu finden“, gibt sich Fernández-Busnadiego optimistisch.