Wie Bakterien Spritzen bauen: Wissenschaftler bauen Transportsystem von Bakterien im Reagenzglas
Für eine erfolgreiche Infektion müssen Bakterien das Immunsystem ihres Wirts gezielt austricksen. Dazu produzieren sie sogenannte Virulenzfaktoren und leiten diese über ein Transportsystem in der Bakterienmembran nach außen. Bei einigen Bakterien ist dieses Transportsystem wie eine Spritze gestaltet. Die Virulenzfaktoren können auf diese Weise direkt in die Wirtszelle injiziert werden. Erstmals ist es jetzt Max-Planck-Wissenschaftlern in Zusammenarbeit mit dem Bundesinstitut für Materialforschung und -prüfung gelungen, grundlegende Mechanismen zu klären, nach denen dieses Transportsystem zusammengebaut wird. Diese Erkenntnisse sind ein wichtiger Schritt für die Entwicklung von Wirkstoffen, die wesentlich früher als Antibiotika in den Verlauf einer Infektion eingreifen könnten.
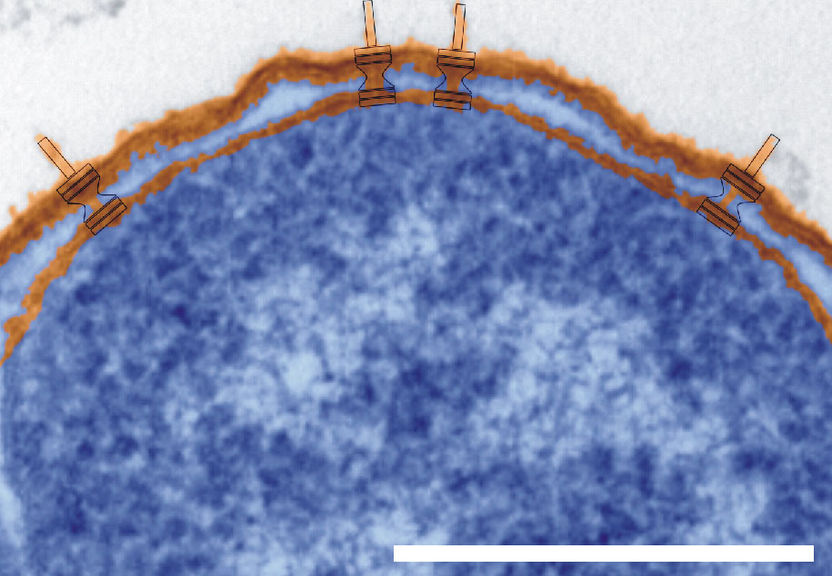
Querschnitt durch Shigella flexneri. Deutlich zu erkennen ist das von den beiden Membranen (orange) eingeschlossene Zellinnere (blau) sowie die nach außen ragenden Nadeln (orange, blau umrandet). Der Balken entspricht einem Mikrometer bzw. einem tausendstel Millimeter.
Ulrike Abu Abed, Diane Schad und Michael Kolbe
Jeden Tag ist der menschliche Organismus dem Angriff verschiedenster Krankheitserreger ausgesetzt. Die meisten Erreger werden dabei durch unser Immunsystem abgewehrt. Um eine erfolgreiche Infektion durchzuführen, müssen Bakterien daher die Zellen ihres Wirts manipulieren, so dass ihr eigenes Überleben gewährleistet ist. Zu diesem Zweck schleusen Bakterien über ein Transportsystem in der Bakterienmembran gezielt Virulenzfaktoren in die Wirtszelle ein. Einige Bakterien, wie die Erreger von Bakterienruhr, Lebensmittelvergiftung, Typhus und Pest, haben dabei ein besonderes Transportsystem entwickelt, das als Typ-III-Sekretionssystem bezeichnet wird. Unter dem Elektronenmikroskop sieht dieses Sekretionssystem wie eine Spritze aus, wobei der Spritzenkörper in die Bakterienmembran eingebettet ist und die Nadel nach außen weist. Die Bakterien können mit Hilfe dieser Nano-Spritzen die Virulenzfaktoren direkt in die Wirtszelle injizieren.
Wie die Bakterien diese Nano-Spritze aufbauen, war bisher weitestgehend unbekannt. Wissenschaftler des Max-Planck-Institut für Infektionsbiologie in Berlin und des Max-Planck-Instituts für biophysikalische Chemie in Göttingen haben es jetzt zusammen mit dem Bundesamt für Materialforschung und -prüfung geschafft, grundlegende Mechanismen des Zusammenbaus der Spritze zu entschlüsseln. Diese Analysen waren möglich, weil es den Forschern gelang, den Spritzenapparat im Reagenzglas nachzubauen. Die nähere Untersuchung dieser Vorgänge zeigte, wie die Proteine zu einer Hohlnadel zusammengebaut werden: Das Bakterium synthetisiert die Proteine in seinem Zellinneren, schleust sie durch die Spritze nach außen und setzt sie eines nach dem anderen auf die Spitze der wachsenden Nadel. Auch konnten die Wissenschaftler zeigen, dass die Proteine beim Zusammenbau der Nadel ihre räumliche Struktur ändern. Es gelang ihnen, die Strukturänderungen während des Nadelaufbaus für jede Aminosäure des Proteins genau zu verfolgen.
Diese Erkenntnisse eröffnen einen Ansatzpunkt für die Entwicklung von Medikamenten, die zu einem sehr frühen Zeitpunkt der Infektion wirken könnten. Diese Wirkstoffe, Antiinfektiva genannt, könnten bereits den Aufbau der Spritze und das Einschleusen von Virulenzfaktoren in die Wirtszelle verhindern. Dies wäre ein wesentlicher Vorteil gegenüber Antibiotika, die erst durch die Membran in das Zellinnere der Bakterien müssen, um ihre Wirkung zu entfalten. Ein weiterer Nachteil von Antibiotika ist, dass diese nicht zwischen "bösen", also krankmachenden, und guten Bakterien unterscheiden. Dies führt in der Praxis oft zu unerwünschten Nebenwirkungen. Auch das Problem der Entwicklung von Antibiotikaresistenzen könnte mit solchen Antiinfektiva umgangen werden.
Die Strukturänderung des Nadelproteins während des Spritzenaufbaus wurde durch Röntgenstruktur-Untersuchungen am BESSY in Berlin und am ESRF in Grenoble sowie durch komplementäre NMR-spektroskopische Untersuchungen in flüssiger und fester Phase am Max-Planck-Institut für biophysikalische Chemie in Göttingen (Abteilung Griesinger) untersucht. Dabei verglichen die Wissenschaftler die dreidimensionale Struktur des Nadelproteins vor und nach der Entstehung der Nadel. BESSY (Berliner Elektronenspeicherring-Gesellschaft für Synchrotronstrahlung) und ESRF (European Synchrotron Radiation Facility, Grenoble) sind Forschungseinrichtungen, die Wissenschaftlern aus aller Welt die Infrastruktur für Strukturuntersuchungen mittels Röntgenstrahlen zur Verfügung stellen.
Originalveröffentlichung: Ömer Poyraz et al.; "Protein refolding is required for assembly of the Type three secretion needle"; Nature Structural & Molecular Biology, 13. Juni 2010
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Ab sofort nichts mehr verpassen: Unser Newsletter für Analytik und Labortechnik bringt Sie jeden Dienstag auf den neuesten Stand. Aktuelle Branchen-News, Produkt-Highlights und Innovationen - kompakt und verständlich in Ihrem Posteingang. Von uns recherchiert, damit Sie es nicht tun müssen.