Analyse komplexer Proteininteraktionen
Wissenschaftler entwickeln neuen Ansatz zur Überprüfung funktionaler Proteinkomplexe
Die Zusammensetzung bestimmter funktionaler Proteinkomplexe kann künftig mit beispielloser Auflösung in ihrer Zellumgebung analysiert werden. Möglich wird dies durch eine neue Untersuchungsmethode, die das Team von Nachwuchsgruppenleiter Dr. Julien Béthune am Biochemie-Zentrum der Universität Heidelberg entwickelt hat. Damit ist es den Wissenschaftlern gelungen, eine lange bestehende Hürde in der molekularen Zellbiologie zu überwinden. Zum Einsatz kommen soll die neue Technik mit dem Namen „split-BioID“ nun bei sogenannten kontextabhängigen Proteinkomplexen, die mit den bisherigen Verfahren nicht analysiert werden konnten.
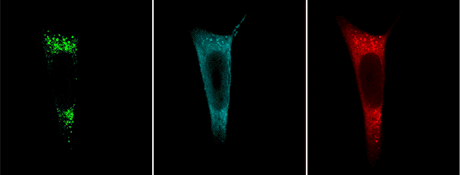
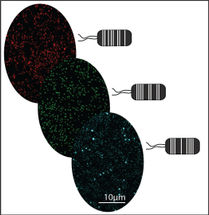
Menschliche Zellen exprimieren zwei interagierende Proteine (in grün und blau), aufgenommen mit Konfokalmikroskopie. Die „split-BioID“-Methode markiert zusätzliche Proteine, die zu demselben Komplex gehören (in rot).
Isabel M. Schopp, Biochemie-Zentrum der Universität Heidelberg
Das Genom lebender Organismen kodiert zehntausende von Proteinen, die eine Vielzahl von Funktionen in der Zelle übernehmen. Damit sie diese Aufgaben erfüllen können, müssen die Proteine mit einander interagieren und sich zu größeren makromolekularen Komplexen zusammenschließen. Für die molekulare Zellbiologie ist die Identifikation von Proteininteraktionen innerhalb solcher Komplexe ein bedeutendes Forschungsfeld. Eine Herausforderung für die Analyse stellt allerdings ihre dynamische Struktur dar. „In der Regel gehört ein einzelnes Protein zu mehreren unterschiedlichen und oftmals überlappenden Komplexen, die sich wiederum je nach Zellkontext und Funktion in der Zelle ändern“, erläutert Dr. Bethune. „Bislang scheiterte die leichte Zuweisung von Proteininteraktionen zu größeren Komplexen an der fehlenden Auflösung.“
In ihrer Forschung kombinieren die Wissenschaftler zwei bereits bestehende Ansätze: Zum einen wird ein Nachweisverfahren namens BioID eingesetzt, das mögliche Interaktionen eines Proteins mithilfe von Markierungen identifiziert. Ergänzt wird dieses Verfahren durch das Konzept des „Protein-Fragments Complementation Assay“ (PCA), einer Methode zum Nachweis von Interaktionen zwischen zwei Proteinen. „Im Vergleich zu den konventionellen Methoden bietet das neue ,split-BioID‘ eine herausragende räumliche und zeitliche Auflösung und ermöglicht die einfache Analyse kontextabhängiger Proteinkomplexe“, betont Isabel Schopp, Doktorandin in der Arbeitsgruppe von Dr. Béthune und Erstautorin der Studie. Die Wissenschaftler erhoffen sich nun ein besseres Verständnis der dynamischen Reaktionen von Zellen mit ihrer Umgebung.
Im Rahmen des Exzellenzclusters CellNetworks der Universität Heidelberg forscht Julien Béthune am Biochemie-Zentrum zu den Mechanismen der posttranskiptionellen Genabschaltung durch die microRNA und ihrem Zusammenspiel mit der Endomembran.
Originalveröffentlichung
Originalveröffentlichung
I.M. Schopp, C.C.A. Ramirez, J. Debeljak, E. Kreibich, M. Skribbe, K. Wild, and Julien Béthune; "Split-BioID a conditional proteomics approach to monitor the composition of spatiotemporally defined protein complexes"; Nature Communications; 8:15690 (published online 6 June 2017)
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Ab sofort nichts mehr verpassen: Unser Newsletter für Analytik und Labortechnik bringt Sie jeden Dienstag auf den neuesten Stand. Aktuelle Branchen-News, Produkt-Highlights und Innovationen - kompakt und verständlich in Ihrem Posteingang. Von uns recherchiert, damit Sie es nicht tun müssen.