Forscher röntgen Proteinkristalle direkt in der Zelle
Neuartiger Ansatz zur Strukturbestimmung von kompliziert handzuhabenden Biomolekülen
Wissenschaftler vom Europäischen Molekularbiologie-Laboratorium EMBL haben gemeinsam mit Forschern von DESY und vom US-Beschleunigerzentrum SLAC in Kalifornien natürlich produzierte Proteinkristalle direkt in biologischen Zellen geröntgt. Die Untersuchung mit dem gegenwärtig weltstärksten Röntgenlaser LCLS am SLAC belegt, dass sich diese natürlichen Kristalle nutzen lassen, um die räumliche Struktur von Proteinen zu bestimmen.
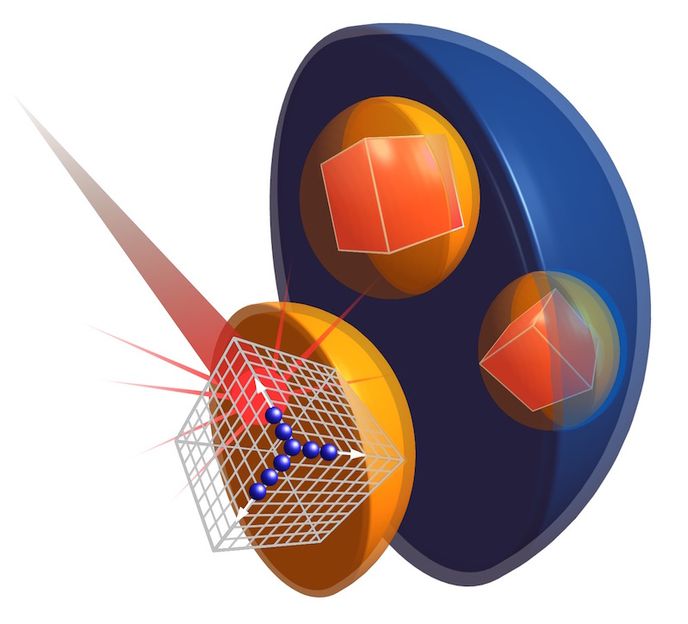
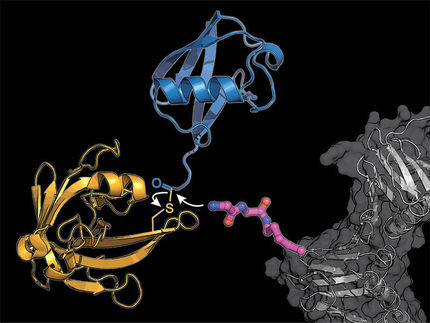
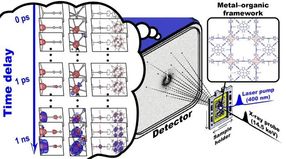
Schematische Darstellung, wie der Strahl eines Freie-Elektronen-Röntgenlasers einen Proteinkristall im Peroxisom einer Hefezelle trifft.
Thomas Seine, EMBL/CFEL
Strukturbiologen unternehmen große Anstrengungen, um die räumliche Struktur von Biomolekülen zu entschlüsseln, denn die Form eines Proteins verrät nicht nur viel über seine Funktion, sie kann auch dazu dienen, maßgeschneiderte neue Medikamente zu entwickeln. Mit Hilfe der sogenannten Kristallographie lässt sich die atomare Struktur von Proteinen untersuchen, aus den Biomolekülen muss jedoch zuvor ein Kristall gezüchtet werden, was meist sehr kompliziert ist und oft an Grenzen führt. Für ihre Untersuchung an der LCLS (Linac Coherent Light Source) haben die Hamburger Forscher stattdessen Kristalle benutzt, die natürlicherweise in Hefezellen wachsen.
Zwar gehört die Kristallzucht zum täglich Brot von Strukturbiologen, die Tatsache, dass Organismen natürlicherweise Proteinkristalle in ihren Zellen bilden, ist jedoch weniger bekannt. „Als wir von diesen natürlich wachsenden Kristallen hörten, haben wir uns gefragt, ob wir diese für Kristallographie-Experimente benutzen können“, berichtet einer der beiden Hauptautoren der Studie, Daniel Passon aus der Gruppe von Matthias Wilmanns in der Hamburger EMBL-Niederlassung. „Proteinkristalle für Kristallographie-Experimente im Labor zu züchten, ist nicht immer einfach – man stelle sich vor, wir könnten Zellen dies für uns tun lassen: eine kleine Kristallfabrik in einer Zelle!“
Die Forscher untersuchten Kristalle, die natürlicherweise in einem Bereich der Zelle vorkommen, die Peroxisomen genannt werden. Diese Zell-Organellen zerlegen große Moleküle wie beispielsweise Fettsäuren und halten dabei giftige Prozesse in ihren eigenen Grenzen und damit fern von den übrigen Teilen der Zelle.
In bestimmten Hefezellen namens Hansenula polymorpha zerlegt das Enzym Alkoholoxidase Methanolmoleküle in nützliche Folgeprodukte. Um den begrenzten Platz im Peroxisom möglichst effektiv zu nutzen, sind die Alkoholoxidase-Moleküle dicht an dicht in einen Kristall gepackt. Trotz der dichten Packung sind die Enzyme in diesem Kristall weiterhin aktiv. „Man stellt sich Kristalle immer als starre Einheiten vor, aber tatsächlich sind sie gar nicht so fest“, erläutert der andere Hauptautor der Studie, Arjen Jakobi vom EMBL. „Das Methanol wandert durch den Kristall, reagiert dabei mit der Oxidase und wird so entgiftet.“
Obwohl alle Hefezellen Peroxisomen besitzen, haben einige mehr als andere, und die Peroxisomengröße schwankt außerdem von Zelle zu Zelle. Diese natürliche Variabilität ist ein Problem, denn Kristallographen benötigen möglichst große und möglichst gleichförmige Kristalle für ihre Untersuchungen. Die Hamburger Forscher arbeiteten daher mit Kollegen der Universität Groningen in den Niederlanden zusammen, die einen Stamm mutierter Hefezellen identifizieren konnten, der nur ein einziges großes Peroxisom pro Zelle produziert. „Groß ist dabei allerdings relativ“, betont Passon. Bei einer Größe von 0,001 Millimeter benötigt die Untersuchung extrem helles Röntgenlicht wie es sogenannte Freie-Elektronen-Röntgenlaser (XFEL) wie die LCLS oder der in Hamburg im Bau befindliche European XFEL erzeugen können. „Freie-Elektronen-Laser produzieren große Mengen Photonen in kurzen Blitzen und erzeugen einen stark gebündelten, parallelen Strahl“, erläutert Untersuchungsleiter Matthias Wilmanns, Chef der Hamburger EMBL-Niederlassung. „Das macht sie ideal, um solche kleinen Kristalle zu untersuchen.“
Das Experiment war nicht nur für die EMBL-Forscher Neuland. „Dieses Forschungsfeld ist noch jung, und es gibt nur wenige führende Experten weltweit“, betont Wilmanns. „Wir haben uns mit der Abteilung für Coherent Imaging am benachbarten Center for Free-Electron Laser Science CFEL bei DESY und der Universität Hamburg zusammengetan und konnten von der erheblichen Erfahrung und Expertise des Abteilungsdirektors Henry Chapman und seinem Team profitieren.“ Nach einigen Voruntersuchungen an den Messstationen bei DESY in Hamburg flogen Wilmanns, Chapman und ihre Teams mit den kostbaren Peroxisomen zum SLAC nach Kalifornien.
Die Forscher präparierten zwei Arten von Proben für ihre Untersuchung: Einmal ließen sie die Peroxisomen in ihren Zellen, bei der anderen holten sie die Peroxisomkristalle aus ihren Zellen heraus. „Überraschenderweise bekamen wir bessere Daten, wenn wir die Peroxisomen in den Zellen durchleuchtet haben“, berichtet Jakobi. „Von dem umgebenden Material gab es viel weniger Störung als erwartet.“
Nachdem die Forscher zeigen konnten, dass sich Strukturdaten von den Kristallen in den Zellen gewinnen lassen, hoffen sie nun, die Kristallproduktion des Peroxisoms für ihre Zwecke ausnutzen zu können, indem sie die Organelle auch Kristalle aus anderen Proteinen produzieren lassen. Damit könnte sich die mühsame Kristallzucht im Labor umgehen lassen. „Dies könnte eine ergänzende Methode für Strukturbiologen werden, die schwer zu kristallisierende Proteine untersuchen“, schließt Wilmanns.