Molekulargenetik vereinfacht Pharmatests
Mediziner klären Wirkungsmechanismen von Krebsmedikamenten auf
Ein neues molekulargenetisches Verfahren hilft, Medikamentenstudien effektiver durchzuführen als bisher, indem es die Wirkungsweise der dabei eingesetzten Moleküle beleuchtet. Das belegt ein Team von Krebsforschern um Professor Dr. Thorsten Stiewe und Dr. Michael Wanzel von der Philipps-Universität Marburg, indem es analysiert, welche Wechselwirkungen das Tumor-unterdrückende Gen p53 mit Bindungspartnern eingeht.
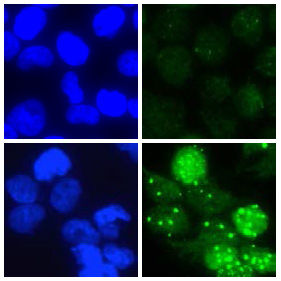
Behandelt man Krebszellen mit RITA (untere Bildreihe), so führt dies zur Beschädigung der DNA (angezeigt durch grüne Färbung), sofern der Reparaturmechanismus der betroffenen Zellen versagt. Die blaue Färbung markiert die Zellkerne.
mikroskopische Aufnahmen: Autoren
Das Gen p53 unterdrückt Krebs, indem es die Teilung der betroffenen Zellen verhindert. In Tumorzellen verliert das Gen seine Wirkung, weil sein Genprodukt an das Protein Mdm2 gekoppelt vorliegt. „Wir wollten herausfinden, wie Moleküle wirken, die die Blockade von p53 aufheben“, sagt Michael Wanzel. Der Humanbiologe von der Philipps-Universität und seine Koautoren untersuchten hierfür die chemische Verbindung Nutlin, die Mdm2 außer Gefecht setzt, indem sie daran bindet. Außerdem nahm das Team den Wirkstoff RITA unter die Lupe, der an p53 andockt und dessen Interaktion mit Mdm2 hemmt.
Sowohl Nutlin als auch RITA verhindern die Vermehrung von Tumorzellen. Geschieht dies, indem p53 seine Wirkung zurückgewinnt? Um das herauszufinden, nutzten die Wissenschaftler das molekulare System CRISPR/Cas9, mit dem sie Mutationen in das p53-Gen einfügten, wodurch dieses seine krebsunterdrückende Aktivität verliert. Das Ergebnis: Während RITA die Vermehrung von Krebszellen auch ohne p53 verhindert, ist Nutlin dazu nicht in der Lage.
Die Autorengruppe vermutet aufgrund weiterer Resultate, dass RITA der Tumorbildung entgegenwirkt, indem es das Erbmaterial DNA schädigt; die betroffenen Krebszellen schalten daraufhin ein Selbstmordprogramm an und sterben ab. Nutlin hingegen führt dazu, dass p53 die Zellteilung unterdrückt. „Unsere Arbeit zeigt, wie die neue Methode der Genomeditierung mittels CRISPR/Cas9 eingesetzt werden kann, um Wirkmechanismen von Pharmaka aufzuklären“, erklärt Mitverfasser Thorsten Stiewe. „Derartige Untersuchungen tragen nicht nur dazu bei, unnötige klinische Studien zu vermeiden, sondern auch die geeignetste Behandlung für jede Patientin und jeden Patienten auszuwählen.“
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Ab sofort nichts mehr verpassen: Unser Newsletter für Analytik und Labortechnik bringt Sie jeden Dienstag auf den neuesten Stand. Aktuelle Branchen-News, Produkt-Highlights und Innovationen - kompakt und verständlich in Ihrem Posteingang. Von uns recherchiert, damit Sie es nicht tun müssen.