Zusammenspiel zweier Leukämiewirkstoffe geklärt
Für fünf Prozent aller an chronisch myeloischer Leukämie erkrankten Patienten gibt es derzeit keine Therapiemöglichkeit, da sie Resistenzen gegen herkömmliche Medikamente entwickelt haben. Die Gruppe von Prof. Stephan Grzesiek vom Biozentrum der Universität Basel hat in Zusammenarbeit mit Dr. Wolfgang Jahnke von Novartis und Kollegen die kombinierte Wirkungsweise zweier verschiedener Wirkstoffe gegen Leukämie untersucht. Sie konnten auf atomarer Ebene aufklären, wie genau beide Wirkstoffe die Struktur eines Enzyms verändern und ihre Kombination die Resistenz überwinden kann.
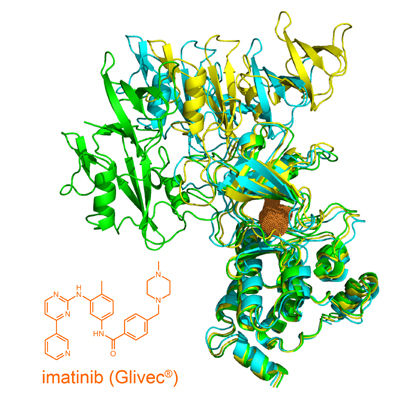
Struktur des offenen Tyrosinkinase-Imatinib-Komplexes.
University of Basel
Die chronische myeloische Leukämie (CML) ist eine Form von Blutkrebs, die auf einer genetischen Störung beruht und zu einer Überproduktion von weissen Blutkörperchen führt. 95 Prozent der erkrankten Patienten können mittlerweile erfolgreich mit dem von der Firma Novartis entwickelten Wirkstoff Imatinib, auch bekannt als Medikament Glivec®, behandelt werden. Imatinib ist ein Hemmstoff, der die ATP-Bindungsstelle der spezifischen Tyrosinkinase Bcr-Abl in erkrankten Blutzellen blockiert und so ihre überschiessende Aktivität senkt. Infolgedessen wird die krankhafte Überproduktion von Leukozyten gestoppt, das Blutbild normalisiert sich.
Imatinib heilt fünf Prozent aller Patienten nicht
Bei fünf Prozent aller CML-Patienten, typischerweise Patienten im fortgeschrittenen Krankheitsstadium, wirkt Imatinib jedoch nicht. Auch andere Hemmstoffe, die in ähnlicher Weise die Tyrosinkinase Bcr-Abl blockieren, sind bei einem Teil der Patienten wirkungslos. Ein Grund dafür ist, dass diese Patienten Mutationen an der ATP-Bindungstelle aufweisen und Imatinib das Enzym nicht mehr inaktivieren kann. Derzeit steht man vor der Entwicklung neuer Therapien, die auch bei Imatinib-resistenten Patienten wirken. Eine der Möglichkeiten basiert auf der Kombination von ATP-Bindungstelle-Inhibitoren mit sogenannten allosterischen Inhibitoren, die an einer anderen Stelle binden.
Warum Wirkstoffkombination erfolgreich bei resistenter CML ist
Warum die Kombination der beiden Wirkstoffe im Tiermodell erfolgreich ist, konnte nun erstmals die Gruppe von Prof. Stephan Grzesiek vom Biozentrum der Universität Basel in Zusammenarbeit mit Dr. Wolfgang Jahnke von Novartis durch Strukturanalyse mittels Kernspinresonanzspektroskopie (NMR) aufklären. Unter physiologischen Bedingungen liegt die Tyrosinkinase Abl in zwei verschiedenen räumlichen Strukturen vor, einer offenen und einer geschlossen. Beide befinden sich in einem sensiblen Gleichgewicht. Die Forscher konnten nun zeigen, dass das Andocken von Imatinib an Abl unerwarteterweise das Gleichgewicht hin zu einer geöffneten Struktur verschiebt. Obwohl selbst blockiert, kann das Enzym in diesem Zustand durch andere Tyrosinkinasen leichter wieder aktiviert werden. Der alternative, allosterische Hemmstoff GNF-5 dagegen festigt den geschlossenen inaktiven Zustand, auch in Kombination mit Imatinib.
«Beide Wirkstoffe zusammen addieren so ihr Potenzial zur Hemmung der Kinaseaktivität. Erst die Strukturanalyse lässt uns verstehen, wie genau GNF-5 die Resistenz gegenüber Imatinib aufheben kann», sagt Lukasz Skora, ehemaliger Postdoktorand im Labor von Stephan Grzesiek. Die Ergebnisse geben erstmals einen vertieften Einblick, wie sich die Abl-Kinase unter dem Einfluss von Inhibitoren verhält, und lassen auf einen Erfolg einer Kombinationstherapie hoffen.
Originalveröffentlichung
Lukasz Skora, Jürgen Mestan, Doriano Fabbro, Wolfgang Jahnke, and Stephan Grzesiek. NMR reveals the allosteric opening and closing of Abelson kinase by ATP-site and myristoyl pocket inhibitors. Proceedings of the National Academy of Sciences PNAS, Published online 4 November 2013.
Originalveröffentlichung
Lukasz Skora, Jürgen Mestan, Doriano Fabbro, Wolfgang Jahnke, and Stephan Grzesiek. NMR reveals the allosteric opening and closing of Abelson kinase by ATP-site and myristoyl pocket inhibitors. Proceedings of the National Academy of Sciences PNAS, Published online 4 November 2013.
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Ab sofort nichts mehr verpassen: Unser Newsletter für Analytik und Labortechnik bringt Sie jeden Dienstag auf den neuesten Stand. Aktuelle Branchen-News, Produkt-Highlights und Innovationen - kompakt und verständlich in Ihrem Posteingang. Von uns recherchiert, damit Sie es nicht tun müssen.