Wasser ist aktives Bauelement in Proteinen
Bochumer Forscher entdecken Protonendiode
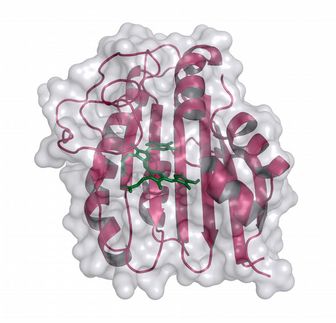
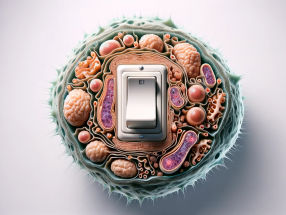
Bochumer Biophysiker haben eine Diode für Protonen entdeckt: Genau wie das elektronische Bauteil die Flussrichtung des elektrischen Stroms vorgibt, sorgt die „Protonendiode“ dafür, dass Protonen nur in eine Richtung durch eine Zellmembran geschleust werden können. Wassermoleküle spielen dabei als aktive Bauteile der Diode eine wichtige Rolle. Die Forscher um Prof. Dr. Klaus Gerwert (Lehrstuhl für Biophysik der RUB) konnten das durch eine Kombination aus Molekularbiologie, Röntgenstrukturanalyse, zeitaufgelöster FTIR-Spektroskopie und Biomolekularen Simulationen beobachten. Protonen treiben Proteinturbinen an Die Protonendiode spielt eine wichtige Rolle bei der Energiegewinnung von Zellen. Lichtgetriebene Protonenpumpen - bestimmte Proteine, die die Zellmembran durchspannen - schleusen Protonen aus der Zelle heraus, so dass außen ein Überdruck entsteht, „ganz ähnlich wie der Wasserdruck an einer Staumauer“, verdeutlicht Prof. Gerwert. An anderer Stelle drängen die Protonen wieder in die Zellen hinein um das Konzentrationsgefälle auszugleichen, und treiben dabei die Turbinen der Zelle an, Proteine namens ATP-asen. Die dabei freiwerdende Energie wird umgewandelt in den universellen Kraftstoff der Zellen, ATP (Adenosintriphosphat). „Dieser Ablauf ist eine Art archaische Photosynthese“, erklärt Prof. Gerwert. „Die Lichtenergie wird letztlich in für den Organismus nutzbare Energie umgewandelt.“ Früher glaubte man an Zufall Die Details dieser Vorgänge sind Gegenstand der Forschung. Besonders die Rolle der Wassermoleküle in Proteinen war lange unklar. „Früher glaubte man, dass die Wassermoleküle durch Zufall in Proteine hineingeraten würden und keine besondere Funktion erfüllten“, so Gerwert. Der in Bochum geborene Manfred Eigen wurde 1967 mit dem Nobelpreis für Chemie ausgezeichnet, weil er erklären konnte, warum Wasser und Eis Protonen extrem schnell leiten können. Die aktuelle Arbeit zeigt, dass auch Proteine genau diesen Mechanismus nutzen und die Wassermoleküle im Protein sehr wohl eine aktive Funktion ausüben. Wasser ist so wichtig wie Aminosäuren Dieses Ergebnis unterstützt die von Klaus Gerwert 2006 in Nature aufgestellte Hypothese, dass proteingebundene Wassermoleküle genauso wichtige katalytische Bauelemente für die Funktion von Proteinen sind wie die Aminosäuren, die Baussteine des Lebens. Folgerichtig haben die Bochumer Biophysiker ihre Arbeit in der Angewandten Chemie Manfred Eigen gewidmet. Eigen hatte seine zentrale Arbeit über Protonentransfer in Wasser 1964 ebenfalls in der Angewandten Chemie veröffentlicht. Klaus Gerwert ist durch Manfred Eigen auf seinen Winterseminaren in Klosters inspiriert worden. Film statt Standbild Die Bochumer Forscher konnten ihre Ergebnisse in einem interdisziplinären Ansatz durch eine Kombination aus Molekularbiologie, Röntgenstrukturanalyse, zeitaufgelöster FTIR-Spektroskopie und Biomolekularen Simulationen erzielen. Diese Kombination zeigt die dynamischen Vorgänge im Protein nach Lichtanregung mit atomarer Auflösung. „Man kann verfolgen, wie das Proton von der zentralen Protonenbindestelle im Innern des Proteins über eine Aminosäure und dann über einen protonierten Wassercluster an die Membranoberfläche transportiert wird“, beschreibt Prof. Gerwert. Der interdisziplinäre Ansatz erweitert jetzt die klassischen Methoden der Strukturbiologie, Röntgenstrukturanalyse und Kernspinresonanzspektroskopie (NMR), da er einen kompletten Film liefert und nicht nur Standbilder von Proteinen. Die Experimente in Bochum wurden durch Computersimulationen in Shanghai ergänzt. Klaus Gerwert ist sowohl Professor an der RUB als auch Direktor am Max-Planck Partner Institut für Computational Biology in Shanghai. Originalveröffentlichungen: Wolf, S., Freier, E., Potschies, M., Hofmann, E. and Gerwert, K.; „Directional Proton Transfer in Membrane Proteins Achieved through Protonated Protein-Bound Water Molecules: A Proton Diode“; Angewandte Chemie International Edition 2010 Garczarek, F., Gerwert, K.; „Functional waters in intraprotein proton transfer monitored by FTIR difference spectroscopy“; Nature 439, 109-112 (2006)

Die Protonendiode in der lichtgetriebenen Protonenpumpe Bakteriorhodopsin.
Ruhr-Universität Bochum
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!